��Ŀ����
20�����ֳ����Ķ����ڷǽ���Ԫ�������ڱ��е����λ��������ʾ��������Ԫ��ԭ�Ӻ�������������������Ӳ��������������û�ѧ����ش�| �� | �� | |
| �� | �� |
��2���ҵ����ֳ������ʷֱ���O2��O3
��3�����ұ�������̬�⻯��ˮ��Һ�����Ե��ǣ�д��ѧʽ��H2S��HCl
��4����Ԫ�غ�����ɵĻ������У��Ⱥ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ����ǣ�д��ѧʽ��H2O2���˻�����ɽ����Թ�ҵ��ˮ��CN-����Ϊ������̼���κͰ�����Ӧ�����ӷ���ʽH2O2+CN-+OH-=CO32-+NH3
��5��ʵ�����Ʊ������ʵ����ӷ���ʽ4H+��Ũ��+2Cl-+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2H2O+Cl2��
��6������Ԫ�ط���ΪX��
��֪����X2��g��+2O2��g���TX2O4��l����H=-19.5KJ/mol
��X2H4��l��+O2��g���TX2��g��+2H2O��g����H=-534.2KJ/mol
��Һ̬X2H4��Һ̬��X2O4��Ӧ������̬X2����̬H2O���Ȼ�ѧ����ʽ2N2H4��l��+N2O4��l��=3N2��g��+4H2O��g����H=-1048.9kJ/mol��
���� ��Ϊ������Ԫ�أ���Ԫ�������ڱ��е�λ�ã���֪�ס���λ�ڵڶ����ڣ�������λ�ڵ������ڣ���Ԫ��ԭ�Ӻ�������������������Ӳ�����������������OԪ�أ�����֪����N������S������ClԪ�أ�
��1������Ԫ��������=���Ӳ���������������=������������
��2���ҵ����ֳ������ʷֱ��������ͳ�����
��3���ס��ҡ�����������̬�⻯��ˮ��Һ�У���ˮ�ʼ��ԡ�ˮ�����ԡ�������Һ�����ԡ�������Һ�����ԣ�
��4����Ԫ�غ�����ɵĻ������У��Ⱥ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ����ǹ������⣻��������ɽ����Թ�ҵ��ˮ��CN-����Ϊ������̼���κͰ����ɵ���غ��֪Ӧ�����������Ӳ��뷴Ӧ����ƽ��д���ӷ��̣�
��5��ʵ�����ö���������Ũ���ᷴӦ�Ʊ�������
��6����֪����N2��g��+2O2��g���TN2O4��l����H=-19.5KJ/mol
��N2H4��l��+O2��g���TN2��g��+2H2O��g����H=-534.2KJ/mol��
���ݸ�˹���ɣ��ڡ�2-�ٿɵ�Ŀ���Ȼ�ѧ����ʽ��
��� �⣺��Ϊ������Ԫ�أ���Ԫ�������ڱ��е�λ�ã���֪�ס���λ�ڵڶ����ڣ�������λ�ڵ������ڣ���Ԫ��ԭ�Ӻ�������������������Ӳ�����������������OԪ�أ�����֪����N������S������ClԪ�أ�
��1����ΪSԪ�أ�ԭ�Ӻ�����3�����Ӳ㡢�������6�����ӣ����λ�ڵ������ڵ�VIA�壬
�ʴ�Ϊ���������ڵ�VIA�壻
��2���ҵ����ֳ������ʷֱ���O2��O3���ʴ�Ϊ��O2��O3��
��3���ס��ҡ�����������̬�⻯��ˮ��Һ�У���ˮ�ʼ��ԡ�ˮ�����ԡ�������Һ�����ԡ�������Һ�����ԣ������⻯��ˮ��Һ�����Ե���H2S��HCl���ʴ�Ϊ��H2S��HCl��
��4����Ԫ�غ�����ɵĻ������У��Ⱥ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ����ǹ������⣬��ѧʽΪH2O2����������ɽ����Թ�ҵ��ˮ��CN-����Ϊ������̼���κͰ����ɵ���غ��֪Ӧ�����������Ӳ��뷴Ӧ�����ӷ���ʽΪ��H2O2+CN-+OH-=CO32-+NH3��
�ʴ�Ϊ��H2O2��H2O2+CN-+OH-=CO32-+NH3��
��5��ʵ�����ö���������Ũ���ᷴӦ�Ʊ���������Ӧ���ӷ���ʽΪ��4H+��Ũ��+2Cl-+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2H2O+Cl2����
�ʴ�Ϊ��4H+��Ũ��+2Cl-+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2H2O+Cl2����
��6����֪����N2��g��+2O2��g���TN2O4��l����H=-19.5KJ/mol
��N2H4��l��+O2��g���TN2��g��+2H2O��g����H=-534.2KJ/mol��
���ݸ�˹���ɣ��ڡ�2-�ٿɵã�2N2H4��l��+N2O4��l��=3N2��g��+4H2O��g����H=2����-534.2KJ/mol��-��-19.5KJ/mol��=-1048.9kJ/mol��
�ʴ�Ϊ��2N2H4��l��+N2O4��l��=3N2��g��+4H2O��g����H=-1048.9kJ/mol��
���� ���⿼��λ�ýṹ�������ϵ��Ӧ�ã����ضԻ�ѧ����Ŀ��飬�����˹��������д�Ȼ�ѧ����ʽ��ע��Ի���֪ʶ���������գ�

| A�� | ��Ӧ����300����п��Ʋ�÷�Ӧ�����ȷ�Ӧ | |
| B�� | ʹ�ô����ɴ���������Ч�� | |
| C�� | �������CO2��������H2��ת���� | |
| D�� | ��ƽ���������з����CH3CH2OH��H2O�����CO2��H2�������� |
 ��ͼ�����ڱ��ж����ڵ�һ���֣�W��X��Y����Ԫ��ԭ�Ӻ��������֮�͵���X����������Xԭ�Ӻ�������������������ȣ�������������ȷ���ǣ�������
��ͼ�����ڱ��ж����ڵ�һ���֣�W��X��Y����Ԫ��ԭ�Ӻ��������֮�͵���X����������Xԭ�Ӻ�������������������ȣ�������������ȷ���ǣ�������| A�� | ����Ԫ�ص�ԭ�Ӱ뾶�Ĵ�С˳����W��Y��X | |
| B�� | W����������Ӧˮ������ǿ�ᣬ��̬�⻯�������� | |
| C�� | XԪ�ص�������ˮ��Һ��ǿ���� | |
| D�� | YԪ�صĵ����Ƿǽ���������Ψһ�ܸ�ˮ�������ҷ�Ӧ�ĵ��� |
| A�� | ֲ���ͺ��ѻ����Ͷ���ʹ��ˮ��ɫ | B�� | ʳ��ֲ�����������Ӫ������ | ||
| C�� | ���͡�ú�͡�±������Ϊ�� | D�� | ��ȩ�ɴ�������ʳƷ������ |

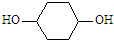 ��д����ȷ�ĺϳ�·�ߣ�
��д����ȷ�ĺϳ�·�ߣ�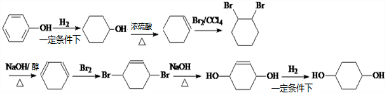 ��
��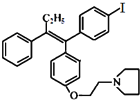 ������������ṹ����
������������ṹ����
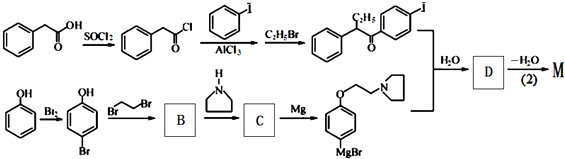


 D
D
 �ж���ͬ���칹�壬�����������FeCl3��ɫ�ڱ����ϵ�һ��ȡ����ֻ��һ�֣�����������ͬ���칹����Ŀ��6�֣�
�ж���ͬ���칹�壬�����������FeCl3��ɫ�ڱ����ϵ�һ��ȡ����ֻ��һ�֣�����������ͬ���칹����Ŀ��6�֣� ����һ�֣�
����һ�֣� +
+ $\stackrel{һ������}{��}$
$\stackrel{һ������}{��}$ +HBr��
+HBr�� ��������̼ԭ�ӵ��л�������Ϊԭ�ϣ��Ʊ����㴼
��������̼ԭ�ӵ��л�������Ϊԭ�ϣ��Ʊ����㴼 �ĺϳ�·��
�ĺϳ�·�� ��������5����Ӧ����
��������5����Ӧ���� ��1����������������Ӧ����NaOH+HCl=NaCl+H2O����Fe+H2SO4=FeSO4+H2����
��1����������������Ӧ����NaOH+HCl=NaCl+H2O����Fe+H2SO4=FeSO4+H2����
 ��
��