题目内容
9.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)?H2(g)+I2(g),在反应达到平衡状态时,下列说法正确的是( )| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、HI的生成速率等于其分解速率,正逆反应速率相等,达平衡状态,故A正确;
B、HI的生成速率小于其分解速率,正逆反应速率不等,未平衡,故B错误;
C、HI的生成速率大于其分解速率,正逆反应速率不等,未平衡,故C错误;
D、无法判断HI的生成速率和分解速率的相对大小,所以可能平衡也可能未平衡,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
11.氢气是未来的理想能源,理由不符合的是( )
| A. | 热值高 | B. | 燃烧时不污染环境 | ||
| C. | 用于制取H2的水资源丰富 | D. | 密度小,便于运输 |
14.已知$\frac{1}{2}$H2(g)+$\frac{1}{2}$C12(g)═HCl(g);△H=-92.3kJ•mol-1,则反应2HCl(g)═H2(g)+Cl2(g)的△H为( )
| A. | +92.3 kJ•mol-1 | B. | -92.3 kJ•mol-1 | C. | -184.6 kJ•mol-1 | D. | +184.6 kJ•mol-1 |
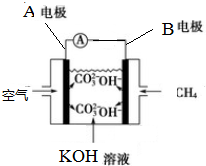 如图是一类甲烷燃烧电池示意图.
如图是一类甲烷燃烧电池示意图.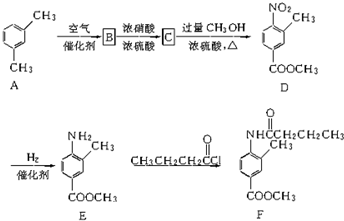
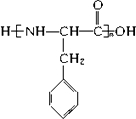 (写结构简式).
(写结构简式).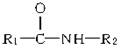 在一定条件下可水解为
在一定条件下可水解为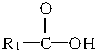 和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是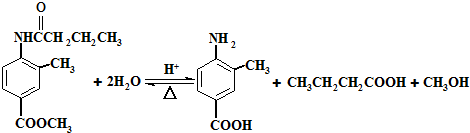 .
.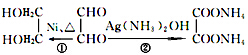 转化的反应方程式.
转化的反应方程式.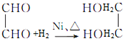 、②
、②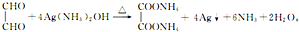 .
.