7. 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 如图是滴定盐酸的曲线 | |
| B. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | E点时溶液中离子浓度为c(Na+)=c(A-) |
6.下列叙述中,不正确的是( )
| A. | 难溶物Ba3(PO4)2的溶度积表达式为Ksp=c(Ba2+)3•c(PO43-)2 | |
| B. | aA(g)+bB(g)?cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、容器体积保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
5. 下表各组物质中,物质之间不可能实现如图所示转化的是:
下表各组物质中,物质之间不可能实现如图所示转化的是:
( )
 下表各组物质中,物质之间不可能实现如图所示转化的是:
下表各组物质中,物质之间不可能实现如图所示转化的是:| 选项 | X | Y | Z | M |
| A | FeS2 | SO2 | SO3 | O2 |
| B | NaOH | Na2CO3 | NaHCO3 | CO2 |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | AlO2- | Al(OH)3 | Al3+ | NaOH |
| A. | A | B. | B | C. | C | D. | D |
4.下列变化中一定没有单质生成的是( )
| A. | 加成反应 | B. | 分解反应 | C. | 置换反应 | D. | 氧化还原反应 |
2.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 碳纤维是一种新开发的材料,它属于合成有机高分子化合物 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| D. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 |
20.下列对事实的解释或由事实所得结论中,正确的是( )
| 事实 | 解释或结论 | |
| A | 常温下铁、铝均不溶于浓硫酸 | 常温下铁、铝与浓硫酸均不反应 |
| B | 测定同浓度的Na2CO3溶液的pH小于Na2SiO3溶液的pH | 非金属性:C<Si |
| C | 向某溶液中加入2滴KSCN浓液、溶液不显红色;再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 用浓、稀硝酸分别完全溶解等质量的铜粉,参加反应的硝酸的物质的量比较:稀硝酸中的<浓硝酸中的 | 稀硝酸氧化性比浓硝酸强 |
| A. | A | B. | B | C. | C | D. | D |
19.下列叙述正确的是( )
| A. | 空气中PM2.5(2.5微米以下的颗粒物)的存在一定能够形成丁达尔效应 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 干冰升华时,分子内共价键会发生断裂 | |
| D. | 常温常压下,5.6 g乙烯与丁烯的混合物中含有的氢原子的数目为0.8NA |
18.下列叙述正确的是( )
0 168817 168825 168831 168835 168841 168843 168847 168853 168855 168861 168867 168871 168873 168877 168883 168885 168891 168895 168897 168901 168903 168907 168909 168911 168912 168913 168915 168916 168917 168919 168921 168925 168927 168931 168933 168937 168943 168945 168951 168955 168957 168961 168967 168973 168975 168981 168985 168987 168993 168997 169003 169011 203614
| A. | 光导纤维中所用材料为晶体硅 | |
| B. | SiO2是酸性氧化物,所以不与任何酸反应 | |
| C. | 可用Na2SiO3溶液和CO2反应来制备H2SiO3 | |
| D. | NaOH溶液可以盛装在带玻璃塞的磨口试剂瓶中 |
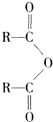 $\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH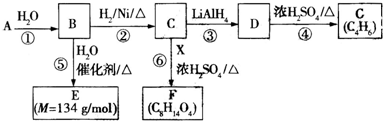
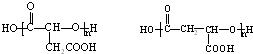 (一种即可).
(一种即可).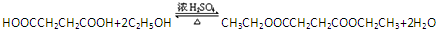 .
. .Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式:
.Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: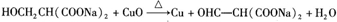 .
.