题目内容
1.G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3.已知:(其中R是烃基)①
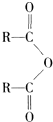 $\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH有关物质的转化关系如图所示,请回答以下问题.
(1)A中不含氧的官能团的名称是碳碳双键;⑤的反应类型是加成反应.
(2)反应②的化学方程式为HOOCCH=CHCOOH+H2$→_{△}^{Ni}$HOOCCH2CH2COOH.
(3)E可在一定条件下通过缩聚反应(填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式:
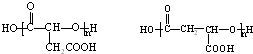 (一种即可).
(一种即可).(4)反应⑥的化学方程式为
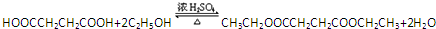 .
.(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式:
 .Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式:
.Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: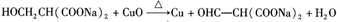 .
.
分析 A是一种五元环状化合物,其核磁共振氢谱只有一个峰,说明A中只含一种类型的H原子,A能水解生成B,B能和氢气发生加成反应生成C,说明B中含有碳碳双键,结合题给信息和A的分子式知,A的结构简式为: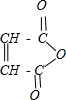 ,A水解生成B,B的结构简式为HOOCCH=CHCOOH,B和氢气发生加成反应生成C,C的结构简式为HOOCCH2CH2COOH,B和水发生反应生成E,根据B和E的摩尔质量知,B发生加成反应生成E,所以E的结构简式为:HOOCCH2CH(OH)COOH,C和X反应生成F,根据F的分子式知,X是乙醇,F的结构简式为CH3CH2OOCCH2CH2COOCH2CH3,C反应生成D,结合题给信息知,D的结构简式为HOCH2CH2CH2CH2OH,D在浓硫酸、加热条件下反应生成G,根据G的分子式知,D发生消去反应生成G,G的结构简式为:CH2=CHCH=CH2.结合有机物的结构和性质以及题目要求可解答该题.
,A水解生成B,B的结构简式为HOOCCH=CHCOOH,B和氢气发生加成反应生成C,C的结构简式为HOOCCH2CH2COOH,B和水发生反应生成E,根据B和E的摩尔质量知,B发生加成反应生成E,所以E的结构简式为:HOOCCH2CH(OH)COOH,C和X反应生成F,根据F的分子式知,X是乙醇,F的结构简式为CH3CH2OOCCH2CH2COOCH2CH3,C反应生成D,结合题给信息知,D的结构简式为HOCH2CH2CH2CH2OH,D在浓硫酸、加热条件下反应生成G,根据G的分子式知,D发生消去反应生成G,G的结构简式为:CH2=CHCH=CH2.结合有机物的结构和性质以及题目要求可解答该题.
解答 解:A是一种五元环状化合物,其核磁共振氢谱只有一个峰,说明A中只含一种类型的H原子,A能水解生成B,B能和氢气发生加成反应生成C,说明B中含有碳碳双键,结合题给信息和A的分子式知,A的结构简式为: ,A水解生成B,B的结构简式为HOOCCH=CHCOOH,B和氢气发生加成反应生成C,C的结构简式为HOOCCH2CH2COOH,B和水发生反应生成E,根据B和E的摩尔质量知,B发生加成反应生成E,所以E的结构简式为:HOOCCH2CH(OH)COOH,C和X反应生成F,根据F的分子式知,X是乙醇,F的结构简式为CH3CH2OOCCH2CH2COOCH2CH3,C反应生成D,结合题给信息知,D的结构简式为HOCH2CH2CH2CH2OH,D在浓硫酸、加热条件下反应生成G,根据G的分子式知,D发生消去反应生成G,G的结构简式为:CH2=CHCH=CH2,
,A水解生成B,B的结构简式为HOOCCH=CHCOOH,B和氢气发生加成反应生成C,C的结构简式为HOOCCH2CH2COOH,B和水发生反应生成E,根据B和E的摩尔质量知,B发生加成反应生成E,所以E的结构简式为:HOOCCH2CH(OH)COOH,C和X反应生成F,根据F的分子式知,X是乙醇,F的结构简式为CH3CH2OOCCH2CH2COOCH2CH3,C反应生成D,结合题给信息知,D的结构简式为HOCH2CH2CH2CH2OH,D在浓硫酸、加热条件下反应生成G,根据G的分子式知,D发生消去反应生成G,G的结构简式为:CH2=CHCH=CH2,
(1)A的结构简式为: ,不含氧的官能团为碳碳双键;B的结构简式为HOOCCH=CHCOOH,E的结构简式为:HOOCCH2CH(OH)COOH,可知B生成C的反应为加成反应,
,不含氧的官能团为碳碳双键;B的结构简式为HOOCCH=CHCOOH,E的结构简式为:HOOCCH2CH(OH)COOH,可知B生成C的反应为加成反应,
故答案为:碳碳双键;加成反应;
(2)B和氢气发生加成反应生成C,反应方程式为:HOOCCH=CHCOOH+H2$→_{△}^{Ni}$HOOCCH2CH2COOH,
故答案为:HOOCCH=CHCOOH+H2$→_{△}^{Ni}$HOOCCH2CH2COOH;
(3)E的结构简式为:HOOCCH2CH(OH)COOH,E能发生缩聚反应,其生成物的结构简式为: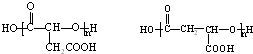 ,
,
故答案为:缩聚反应;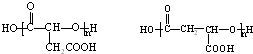 ;
;
(4)1、4-丁二酸和乙醇发生酯化反应,反应方程式为: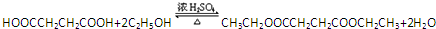 ,
,
故答案为: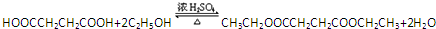 ;
;
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,符合条件的有: ,二者都能与NaOH反应,其产物能与灼热的氧化铜反应的为
,二者都能与NaOH反应,其产物能与灼热的氧化铜反应的为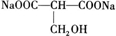 ,则M为HOCCH(COONa)2,反应的方程式为
,则M为HOCCH(COONa)2,反应的方程式为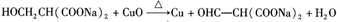 ,
,
故答案为: ;
;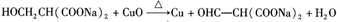 .
.
点评 本题考查有机物推断,题目难度较大,明确有机物的断键和成键方式是解决有机题的关键,难点是同分异构体的书写,不仅有碳链异构、官能团异构,还有顺反异构,要结合题给信息进行分析解答.

 智慧小复习系列答案
智慧小复习系列答案| A. | 碘和四氯化碳 | B. | AgCl和水 | ||
| C. | 一氧化碳和二氧化碳 | D. | 铁粉和铜粉 |
| A. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| B. | c(Al3+)=0.5 mol•L-1的溶液中:Na+、K+、AlO2-、SO42- | |
| C. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | |
| D. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- |
| 实验操作 | 实验目的 | |
| A | 将卤代烃加入到热NaOH溶液中一段时间后,取上层液体,加入AgNO3液产生沉淀 | 证明卤代烃中含有卤元素 |
| B | 向丙烯醛(CH2=CH-CHO)中加入足量新制银氨溶液后,滴入KMnO4(H+)溶液,观察紫色褪去 | 证明结构中存在碳碳双键 |
| C | 淀粉在硫酸催化作用下水解,将新制氢氧化铜悬浊液加入到水解后的溶液中 | 检验淀粉水解的产物葡萄糖 |
| D | 向纯碱中滴加醋酸,将产生的气体先通入饱和碳酸氢钠溶液再通入苯酚钠浓溶液 | 证明酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 难溶物Ba3(PO4)2的溶度积表达式为Ksp=c(Ba2+)3•c(PO43-)2 | |
| B. | aA(g)+bB(g)?cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、容器体积保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
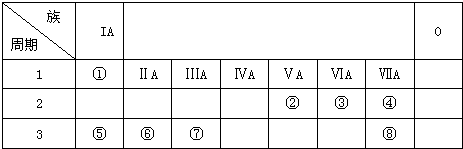
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )| A. | W的氢化物沸点高于水的沸点 | |
| B. | Q与氢形成的化合物一定含极性键,可能含有非极性键 | |
| C. | R的最高正价氧化物的水化物是弱电解质 | |
| D. | T与W的化合物可通过T、W的简单离子的水溶液混合制取 |
| A. | 为减小酸碱中和滴定的使用误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(I)△H=-57.3kJ•mol-1,可知100mL 0.1mol•L-1的氨水混合,放出的热量等于0.573kJ |
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:
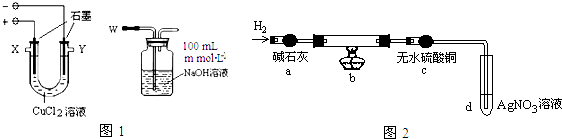
(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
②红色物质可能有Cu;或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是$\frac{{W}_{1}-{W}_{2}}{35.5}$mol.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为$\frac{20m-nV}{40}$mol•L-1.
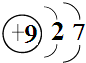 .
.