题目内容
7. 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 如图是滴定盐酸的曲线 | |
| B. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | E点时溶液中离子浓度为c(Na+)=c(A-) |
分析 A.根据盐酸和醋酸在滴定开始时的pH与1的关系进行判断;
B.根据氢氧化钠和醋酸以及盐酸反应的原理结合给定的物质的量计算来回答;
C.根据酸和碱反应的化学方程式来计算回答;
D.E点溶液是中性,此时c(H+)=c(OH-),根据溶液中的电荷守恒来判断.
解答 解:A.滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图2,故A正确;
B.当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故B错误;
C.左图为滴定醋酸溶液,B点溶液显中性,醋酸过量,反应消耗溶液体积:V(NaOH)<V(HA),故C正确;
D.达到E状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为c(Na+)=c(A-),故D正确;
故选B.
点评 本题考查离子浓度大小比较、酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及盐类的水解和溶液离子浓度的大小比较等知识,注意根据电荷守恒、物料守恒进行判断离子浓度大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有关过氧化钠的叙述中,不正确的是( )
| A. | 过氧化钠为淡黄色固体 | |
| B. | 过氧化钠与水反应是放热反应 | |
| C. | 过氧化钠可用于呼吸面具中作为氧气的来源 | |
| D. | 过氧化钠与二氧化碳反应是置换反应 |
18.如图所示,电流计G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.则A、B、C为( )

| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是稀AgNO3溶液 | D. | A是Ag,B是Fe,C是稀AgNO3溶液 |
15.以下化学用语正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | CH2F2的电子式: | D. | 甲醛的结构式: |
2.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 碳纤维是一种新开发的材料,它属于合成有机高分子化合物 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| D. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 |
12.小苏打作为食品制作过程中的膨松剂在食品加工产业上有广泛的用途.

(1)某小组拟研究放置己久的小苏打样品中纯碱的质量分数.限选试剂和仪器:NaHCO3样品、碱石灰、0.1mol/LHCl、0.1mol/LH2SO4、浓H2SO4、烧瓶、双孔塞、玻璃导管、胶管、广口瓶、干燥管.
①写出本实验小苏打样品与酸反应的全部化学方程式(两条)2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,Na2CO3+H2SO4=Na2SO4+CO2↑+H2O.
②设计实验方案:实验中除称量样品质量外,还需测定生成CO2的质量.
③设计实验装置,完成下图装置示意图及标注.
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂质量,需记录的待测物理量和所拟定的数据;数据用字母表示).
(2)根据此实验得到的数据,测定结果有误差.因为实验装置还存在一个明显缺陷,该缺陷是需设计一个将A、B中的CO2全部吹入C中的装置.

(1)某小组拟研究放置己久的小苏打样品中纯碱的质量分数.限选试剂和仪器:NaHCO3样品、碱石灰、0.1mol/LHCl、0.1mol/LH2SO4、浓H2SO4、烧瓶、双孔塞、玻璃导管、胶管、广口瓶、干燥管.
①写出本实验小苏打样品与酸反应的全部化学方程式(两条)2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,Na2CO3+H2SO4=Na2SO4+CO2↑+H2O.
②设计实验方案:实验中除称量样品质量外,还需测定生成CO2的质量.
③设计实验装置,完成下图装置示意图及标注.
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂质量,需记录的待测物理量和所拟定的数据;数据用字母表示).
| 物理量 | 样品质量/g | … | ||
| 实 验 | a | … |
16.如图是元素周期表的一部分:
请用表中序号①~⑨的元素符号或化学式填空:
(1)在这些元素中,化学性质最不活泼的元素符号为Ar,其原子的原子结构示意图为 .
.
(2)地壳中含量最多的金属元素是Al;⑦、⑧两种元素的氢化物稳定性由强到弱的顺序为HCl>H2S.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH.
(5)元素③的氢氧化物溶液与元素⑤的氢氧化物反应的离子方程式为:OH-+Al(OH)3=AlO2-+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,化学性质最不活泼的元素符号为Ar,其原子的原子结构示意图为
 .
.(2)地壳中含量最多的金属元素是Al;⑦、⑧两种元素的氢化物稳定性由强到弱的顺序为HCl>H2S.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH.
(5)元素③的氢氧化物溶液与元素⑤的氢氧化物反应的离子方程式为:OH-+Al(OH)3=AlO2-+2H2O.
17.下列离子方程式正确的是( )
| A. | 向AlCl3溶液中逐渐滴入NaOH溶液至过量:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NaOH溶液中逐渐滴入AlCl3溶液至过量:Al3++4OH-═AlO2-+2H2O | |
| C. | 在氨水中加入几滴硝酸铁溶液:Fe3++3OH-═Fe(OH)3↓ | |
| D. | 向Na2CO3溶液中滴加几滴稀盐酸:CO32-+H+═HCO3- |
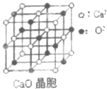 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,