题目内容
5. 下表各组物质中,物质之间不可能实现如图所示转化的是:
下表各组物质中,物质之间不可能实现如图所示转化的是:| 选项 | X | Y | Z | M |
| A | FeS2 | SO2 | SO3 | O2 |
| B | NaOH | Na2CO3 | NaHCO3 | CO2 |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | AlO2- | Al(OH)3 | Al3+ | NaOH |
| A. | A | B. | B | C. | C | D. | D |
分析 A、FeS2和氧气反应生成二氧化硫和铁的氧化物,二氧化硫可以继续和氧气反应生成三氧化硫;
B、NaOH与少量二氧化碳反应生成碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠;
C、氯气与铁化合生成氯化铁,氯化铁与铁反应生成氯化亚铁;
D、偏铝酸盐和可溶性的铝盐反应生成氢氧化铝,但是氢氧化铝和可溶性的铝盐之间不反应.
解答 解:A、FeS2和氧气反应生成二氧化硫和铁的氧化物,二氧化硫可以继续和氧气反应生成三氧化硫,符合图中转化,故A不选;
B、NaOH与少量二氧化碳反应生成碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,符合图中转化,故B不选;
C、氯气与铁化合生成氯化铁,氯化铁与铁反应生成氯化亚铁,符合图中转化,故C不选;
D、偏铝酸盐和可溶性的铝盐反应生成氢氧化铝,但是氢氧化铝和可溶性的铝盐之间不反应,不符合图中转化,故D选.
故选D.
点评 本题考查无机物的推断,侧重物质转化及物质性质的考查,明确常见物质的化学性质为解答的关键,注意选项A中氯气具有强氧化性,题目难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
9.鉴别CO2和SO2,可以选用的试剂是( )
| A. | 稀盐酸 | B. | 品红溶液 | C. | 氢氧化钠溶液 | D. | 氯化钠溶液 |
16.下列说法中正确的是( )
| A. | 原子及其离子的核外电子层数等于该元素所在周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10列的元素都是金属元素 | |
| C. | 稀有气体原子的最外层电子数都是8个 | |
| D. | 原子的最外层电子数等于该元素所在族序数 |
13.甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是( )
| A. | CH3Cl不存在同分异构体 | B. | CH2Cl2不存在同分异构体 | ||
| C. | CHCl3不存在同分异构体 | D. | CCl4不存在同分异构体 |
20.下列对事实的解释或由事实所得结论中,正确的是( )
| 事实 | 解释或结论 | |
| A | 常温下铁、铝均不溶于浓硫酸 | 常温下铁、铝与浓硫酸均不反应 |
| B | 测定同浓度的Na2CO3溶液的pH小于Na2SiO3溶液的pH | 非金属性:C<Si |
| C | 向某溶液中加入2滴KSCN浓液、溶液不显红色;再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 用浓、稀硝酸分别完全溶解等质量的铜粉,参加反应的硝酸的物质的量比较:稀硝酸中的<浓硝酸中的 | 稀硝酸氧化性比浓硝酸强 |
| A. | A | B. | B | C. | C | D. | D |
17.常温下,下列溶液中各组离子一定大量共存的是( )
| A. | 0.1mol•L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3- | |
| B. | 中性溶液中:Fe3+、Na+、Br-、SO42- | |
| C. | 在含有苯酚的溶液中:K+、NH4+、Br-、Fe3+ | |
| D. | 澄清透明的溶液中:K+、Al3+、SO42-、MnO4- |
14.已知反应X+Y=M+N为吸热反应,对该反应的下列说法中正确的是( )
| A. | X的能量一定低于M的能量 | |
| B. | Y的能量一定低于N的能量 | |
| C. | X和Y的总能量一定低于M和N的总能量 | |
| D. | 因该反应为吸热反应,故该反应一定要加热才可发生 |
15.现有两种金属的混合物共4g,与足量氯气反应后,固体增重7.1g,另取4g该金属混合物,投入到足量盐酸中,产生2.24L(标准状况)H2.则该混合物的组成不可能是( )
| A. | Cu和Al | B. | Mg和Al | C. | Al和 Zn | D. | Mg 和 Zn |
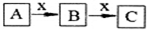 A、B、C、x均为中学化学常见物质,且A、B、C含有同一种元素,在一定条件下发生如图所示的化学变化.则x不可能是( )
A、B、C、x均为中学化学常见物质,且A、B、C含有同一种元素,在一定条件下发生如图所示的化学变化.则x不可能是( )