9.下列物质中,不能使溴的四氯化碳溶液和高锰酸钾酸性溶液褪色的是( )
| A. | C5H12 | B. | 丙烯 | C. | C2H4 | D. | 乙炔 |
6.下列有关热化学方程式的叙述正确的是( )
| A. | 若C(s)+O2(g)=CO2(g)△H1,CO2(g)+C(s)=2CO(g)△H2,2CO(g)+O2(g)=2CO2(g)△H3,则反应热的关系:△H1=△H2+△H3 | |
| B. | 若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,则反应热的关系:△H4=△H5 | |
| C. | 若2SO2(g)+O2(g)=2SO3(g)△H<O,则物质的稳定性:SO2>SO3 | |
| D. | 若断裂1molH2(g)中的H-H键、断裂1 molO2(g)中的共价键分别需要吸收436 kJ、498 kJ的能量,生成H2O(g)中的1 mol H-O键能放出463kJ的能量,则2H2(g)+O2(g)=2H2O(g)△H=-482kJ.mol-1 |
4. 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
(1)按要求完成填空
①2HCl(g)=H2(g)+Cl2(g)△H=+183kJ/mol;
②N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol
则N-H键的键能是391kJ/mol
(2)1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式为:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ•mol-1
(3)已知:
2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H=-1 644.3kJ•mol-1
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-815.88kJ•mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1.
0 168790 168798 168804 168808 168814 168816 168820 168826 168828 168834 168840 168844 168846 168850 168856 168858 168864 168868 168870 168874 168876 168880 168882 168884 168885 168886 168888 168889 168890 168892 168894 168898 168900 168904 168906 168910 168916 168918 168924 168928 168930 168934 168940 168946 168948 168954 168958 168960 168966 168970 168976 168984 203614
 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能/kJ•mol | 243 | 436 | 431 | 946 |
①2HCl(g)=H2(g)+Cl2(g)△H=+183kJ/mol;
②N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol
则N-H键的键能是391kJ/mol
(2)1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式为:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ•mol-1
(3)已知:
2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H=-1 644.3kJ•mol-1
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-815.88kJ•mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1.
 .
.

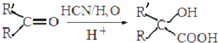
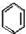 生成
生成 的反应类型是取代反应.
的反应类型是取代反应. .
. .
.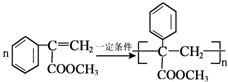 .
.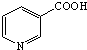 )俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空:
)俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空: .试剂浓硝酸、浓硫酸.
.试剂浓硝酸、浓硫酸.