题目内容
8.(1)已知柠檬酸仅由C、H、O三种元素组成.其分子量不超过200,其中含氧元素58.3%.通过计算并写出柠檬酸的分子式C6H8O7.(2)已知某有机物的分子式为C9H10O3且具有下列性质:
①该物质能与碳酸氢钠溶液反应生成无色无味气体.
②16.6g该物质与足量金属钠反应可生成氢气2.24L(已折算成标准状况).该有机物的结构可能6种,请写出其中一种的结构简式
 .
.
分析 (1)已知柠檬酸仅由C、H、O三种元素组成.其分子量不超过200,其中含氧元素58.3%,则200×58.3%=116,N(O)=$\frac{116}{16}$=7.25≈7,则分子中O原子数为7,
所以Mr=$\frac{7×16}{58.3%}$=192,则C、H元素总质量为192×(1-58.3%)=80,N(C)=$\frac{80}{12}$=6…8,所以分子中含有6个C和8个H;
(2)已知某有机物的分子式为C9H10O3,能与碳酸氢钠溶液反应生成无色无味气体,说明含有-COOH,16.6g即0.1mol该物质与足量金属钠反应可生成氢气2.24L,则分子中除了含有羧基外还有一个-OH,据此判断同分异构体.
解答 解:(1)已知柠檬酸仅由C、H、O三种元素组成.其分子量不超过200,其中含氧元素58.3%,则200×58.3%=116,N(O)=$\frac{116}{16}$=7.25≈7,则分子中O原子数为7,
所以Mr=$\frac{7×16}{58.3%}$=192,则C、H元素总质量为192×(1-58.3%)=80,N(C)=$\frac{80}{12}$=6…8,所以分子中含有6个C和8个H,所以柠檬酸的分子式为C6H8O7;
故答案为:C6H8O7;
(2)已知某有机物的分子式为C9H10O3,能与碳酸氢钠溶液反应生成无色无味气体,说明含有-COOH,16.6g即0.1mol该物质与足量金属钠反应可生成氢气2.24L,则分子中除了含有羧基外还有一个-OH,则该物质的结构简式为: 、
、 、
、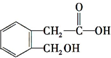 、
、 、
、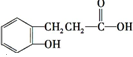 、
、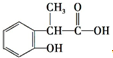 ;
;
故答案为:6; .
.
点评 本题考查有机物分子式的确定、有机物的推断,是对有机知识的综合运用,根据题目信息计算推断C的结构简式是解题的关键,能较好的考查考生的阅读、自学能力和思维能力,题目难度中等.

(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐.
(2)实验和探究:
①NH4+的验证:取少量固体药品于试管中,然后滴加NaOH浓溶液,加热试管,将湿润的红色石蕊试纸置于试管口部,若红色石蕊试纸变蓝,则证明含NH4+.
②阴离子的探究:取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入图1装置.观察到的现象是溴水无明显变化,澄清石灰水变浑浊.再向滴加稀盐酸反应后的试管中加Ba(OH)2溶液,无明显现象.
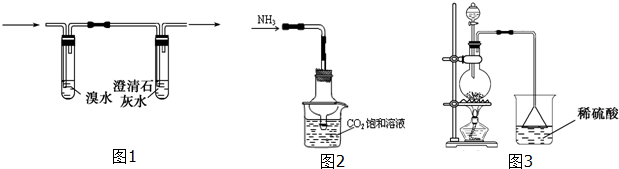
初步结论:“氢铵”是碳酸的铵盐.
③思考:上述实验步骤②加入Ba(OH)2溶液的目的是检验是否存在SO42-.根据初步实验结论,提出假设:
假设1:氢铵成分是NH4HCO3 假设2:氢铵成分是(NH4)2CO3
假设3:氢铵成分是(NH4)2CO3和NH4HCO3的混合物.
④根据上述假设,设计实验得出结论.限选试剂和仪器有:CaCl2溶液、品红溶液、Ba(NO3)2溶液、1.0mol/L盐酸、1.0mol•L-1 NaOH溶液、饱和澄清石灰水、BaCl2溶液、Ba(OH)2溶液、试管、胶头滴管
| 实验步骤 | 预期现象及结论 |
| 步骤1:取适量“氢铵”配制成溶液,取1~2ml试液于一支洁净的试管中,加足量BaCl2溶液,充分振荡. | ①若出现白色沉淀,证明氢铵中含有(NH4)2CO3; ②若没有明显现象可能含有NH4HCO3 |
| 步骤2:静置,取上层清液少许于另一试管中, 继续滴加滴加适量Ba(OH)2溶液,振荡观察现象. | 若出现白色沉淀,证明氢铵中含有NH4HCO3结合步骤1②,则假设1成立; 结合步骤1①,则假设3成立; 仅在步骤1中产生白色沉淀,则假设2成立;. |
①根据氢铵成分,设计小组根据下面实验装置来制备NH4HCO3是否合理否(填“是”或“否”)
②该实验小组设计了以下实验方案测定氢铵中的含氮量,请你阅读后进行评价:准确称取一定质量的样品,放入图2方案的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图3装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量).然后进行计算,可得化肥的含氮量.请你评价上述方案是否合理.若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
不合理,装置中没有干燥装置,稀硫酸吸收了较多水蒸气,误差太大;在烧杯前加一个装有碱石灰的干燥管.
| A. | 大量生产、使用能过滤PM2.5的口罩 | |
| B. | 用石灰对煤燃烧后形成的烟气进行脱硫处理 | |
| C. | 开发利用太阳能、氢能、风能等清洁能源 | |
| D. | 研究廉价、高效的催化剂,以降低汽车尾气中有害物质的含量 |
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. | 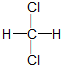 和 和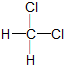 互称同分异构体 互称同分异构体 |
| A. | 在相同温度下,Na2CO3比NaHCO3的溶解度小 | |
| B. | 可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 可用加热的方法除去Na2CO3中混有的NaHCO3杂质 | |
| D. | Na2CO3和NaHCO3固体分别与盐酸反应产生等量的CO2时,后者消耗的H+多 |
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、Al3+、SO42-、NH3•H2O | ||
| C. | Na+、K+、SO32-、Cl2 | D. | Na+、Mg2-、SO42-、H+ |
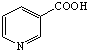 )俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空:
)俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空: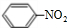 .试剂浓硝酸、浓硫酸.
.试剂浓硝酸、浓硫酸.