题目内容
10.(1)写出下列基团(或官能团)的名称或结构简式:-CH2CH3乙基、-OH羟基、羧基-COOH、-COOR酯基、
(2)若电石中的碳化钙和水能完全反应,实验产生的气体有难闻的气味,可以用硫酸铜溶液或氢氧化钠溶液(填试剂)加以除去.
(3)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是80%.
分析 (1)结合常见的烃基、官能团的名称和结构简式解答;
(2)生成的气体中含有硫化氢气体,硫化氢能与硫酸铜溶液或氢氧化钠溶液反应;
(3)根据方程式 CaC2 +H2O═C2H2↑+Ca(OH)2可知:1mol碳化钙(即64g碳化钙)生成标况下1mol乙炔(即22.4L乙炔),然后根据生成的乙炔的体积即可求出电石样品中碳化钙的质量,然后根据质量分数求算即可.
解答 解:(1)-CH2CH3为乙基,-OH 为羟基,羧基为-COOH,-COOR为酯基,
故答案为:乙基;羟基;-COOH;酯基.
(2)生成的气体中含有硫化氢气体,硫化氢能与硫酸铜溶液或氢氧化钠溶液反应,可以用硫酸铜溶液或氢氧化钠溶液除去;
故答案为:硫酸铜溶液或氢氧化钠溶液.
(3)根据方程式计算:
CaC2 +H2O═C2H2↑+Ca(OH)2
64g 22.4L
m 448×10-3L
m=$\frac{64g×448×1{0}^{-3}L}{22.4L}$=1.28g
所以电石中碳化钙的百分含量是$\frac{1.28}{1.60}$×100%=80%,
点评 本题考查官能团的名称、乙炔的制备和测量问题,本题难度不大,注意气体制备方法,特别是实验仪器的连接顺序一定要掌握好.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
15.四种主族元素的离子aX2+,bY+,cZ-和dR2-(a,b,c,d为元素的原子序数),它们具有相同的电子层结构,对下列叙述的判断正确的是( )
①c-b=2 ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y.
①c-b=2 ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y.
| A. | ②③正确 | B. | 只有③正确 | C. | ①②③④正确 | D. | ①②③正确 |
16.反应X(g)+Y(g)?2Z(g)△H<0,达到平衡时,下列说法正确的是( )
| A. | 增大c(X),X的转化率增大 | B. | 降低温度,Y的转化率增大 | ||
| C. | 减小容器体积,平衡向右移动 | D. | 加入催化剂,Z的产率增大 |
15.铀的一种核素${\;}_{92}^{235}$U,这里的“235”表示的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
2.下列气体中,不能用排空气法收集的是( )
| A. | NO | B. | SO2 | C. | CO2 | D. | NO2 |
19.对下列事故预防或处理方法正确的是( )
| A. | 钠、钾着火时用水灭火 | |
| B. | 点燃氢气前要验纯,点燃甲烷前不必验纯 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上浓硫酸 | |
| D. | 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌 |
 .
.

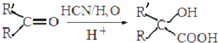
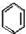 生成
生成 的反应类型是取代反应.
的反应类型是取代反应. .
. .
.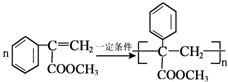 .
.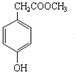 的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气.
的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气.