题目内容
5.以苯为主要原料,制取高分子材料N和R的流程如下:
已知:
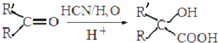
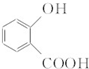
(1)B中含氧官能团的名称是羧基、羟基.
(2)由
 生成
生成 的反应类型是取代反应.
的反应类型是取代反应.(3)反应Ⅰ的反应条件是氢氧化钠水溶液加热后酸化.
(4)化合物C的结构简式是
 .
.(5)反应Ⅱ的化学方程式是
 .
.(6)下列说法正确的是cd(选填序号字母).
a.A可与NaOH溶液反应 b.常温下,A能和水以任意比混溶
c.化合物C可使高锰酸钾酸性溶液褪色 d.E存在顺反异构体
(7)反应Ⅲ的化学方程式是
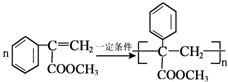 .
.(8)符合下列条件的B的同分异构体有6种.
a.能与饱和溴水反应生成白色沉淀 b.属于酯类 c.苯环上只有两个对位取代基.
分析 苯与氯气发生取代反应生成氯苯,氯苯反应得到I,I与C反应得到N,结合N的结构可知,A为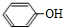 ,C为
,C为 ,反应I应是在氢氧化钠水溶液、加热条件下水解后酸化.苯与CH3COCl发生取代反应生成
,反应I应是在氢氧化钠水溶液、加热条件下水解后酸化.苯与CH3COCl发生取代反应生成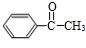 ,由反应信息可知B为
,由反应信息可知B为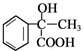 ,B与甲醇发生酯化反应生成D为
,B与甲醇发生酯化反应生成D为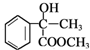 ,D发生消去反应生成E为
,D发生消去反应生成E为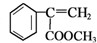 ,E发生加聚反应生成R为
,E发生加聚反应生成R为 ,据此解答.
,据此解答.
解答 解:苯与氯气发生取代反应生成氯苯,氯苯反应得到I,I与C反应得到N,结合N的结构可知,A为 ,C为
,C为 ,反应I应是在氢氧化钠水溶液、加热条件下水解后酸化.苯与CH3COCl发生取代反应生成
,反应I应是在氢氧化钠水溶液、加热条件下水解后酸化.苯与CH3COCl发生取代反应生成 ,由反应信息可知B为
,由反应信息可知B为 ,B与甲醇发生酯化反应生成D为
,B与甲醇发生酯化反应生成D为 ,D发生消去反应生成E为
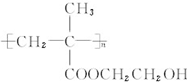
,D发生消去反应生成E为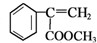 ,E发生加聚反应生成R为
,E发生加聚反应生成R为 .
.
(1)B为 ,含氧官能团的名称是:羧基、羟基,故答案为:羧基、羟基;
,含氧官能团的名称是:羧基、羟基,故答案为:羧基、羟基;
(2)由 生成
生成 的反应类型是:取代反应,故答案为:取代反应;
的反应类型是:取代反应,故答案为:取代反应;
(3)反应Ⅰ是 转化为
转化为 ,反应条件是:氢氧化钠水溶液加热后酸化,故答案为:氢氧化钠水溶液加热后酸化;
,反应条件是:氢氧化钠水溶液加热后酸化,故答案为:氢氧化钠水溶液加热后酸化;
(4)化合物C的结构简式是: ,故答案为:
,故答案为: ;
;
(5)反应Ⅱ的化学方程式是: ,
,
故答案为: ;
;
(6)a.A为 ,含有酚羟基,可与NaOH溶液反应,故a正确;
,含有酚羟基,可与NaOH溶液反应,故a正确;
b. 在常温下微溶于水,高于65℃时,能和水混溶,故b错误;
在常温下微溶于水,高于65℃时,能和水混溶,故b错误;
c.化合物C为 ,含有醛基、碳碳双键,可使高锰酸钾酸性溶液褪色,故c正确;
,含有醛基、碳碳双键,可使高锰酸钾酸性溶液褪色,故c正确;
d.E为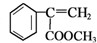 ,碳碳双键中其中一个碳原子连接2个H原子,没有顺反异构体,故d错误,
,碳碳双键中其中一个碳原子连接2个H原子,没有顺反异构体,故d错误,
故选:cd;
(7)反应Ⅲ的化学方程式是: ,
,
故答案为: ;
;
(8)符合下列条件的B( )的同分异构体:
)的同分异构体:
a.能与饱和溴水反应生成白色沉淀,说明含有酚羟基,且至少酚羟基对位或邻位有H原子,b.属于酯类 c.苯环上只有两个对位取代基,另外的取代基为:-OOCCH2CH3、或-CH2OOCCH3、或-COOCH2CH3、或-CH2CH2OOCH、或-CH(CH3)OOCH、或-CH2COOCH3,共有6种,
故答案为:6.
点评 本题考查有机物的推断,结合有机物的结构、反应条件下进行推断,需要学生对给予的信息进行利用,较好的考查学生的自学能力、分析推理能力,需要学生熟练掌握官能团的性质与转化,难度中等.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
| A. | 该有机物的分子式为:C10H9O5Br | |
| B. | 该有机物能发生银镜反应 | |
| C. | 1mol该有机物能与含3mol Br2的溴水发生加成反应 | |
| D. | 该有机物与热的NaOH溶液反应后有HOCH2COONa生成 |
| A. | 苯中的甲苯(溴水) | B. | 95.6%乙醇中的水(CaO) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 溴苯中的溴(苯) |
(1)工业上可以用Na2SO3 还原CuSO4 的方法制备Cu2O,反应控制的温度为100℃~105℃,pH为3.5~5.5,其反应的化学方程式为2CuSO4+3Na2SO3═Cu2O+3Na2SO4+2SO2↑.也可以用电解法制备,电解时以铜作阳极,氢氧化钠为电解质溶液,写出电解时阳极发生的电极反应:2Cu-2e-+2OH-=Cu2O↓+H2O.
(2)某同学在实验室发现了一瓶使用过的红色粉末,且实验室中只有Fe2O3 和Cu2O两种颜色为红色的试剂,因此他就通过实验来探究该红色粉末的成分,已知Cu2O是一种碱性氧化物,溶于稀H2SO4生成Cu和CuSO4 ,在空气中加热生成CuO.
①请完成Cu2O与稀H2SO4反应的化学方程式:
Cu2O+H2SO4═Cu+CuSO4 +H2O;
②提出合理的假设:
假设1:红色粉末是Fe2O3 ;
假设2:红色粉末是Cu2O;
假设3:红色粉末是Fe2O3 和Cu2O的混合物.
③设计探究实验:
共选择的试剂:3mol•L-1 稀H2SO4、1mol•L-1 NaOH溶液、20%的KSCN溶液,3%的H2O2 溶液,稀HNO3、光亮的铁丝.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量红色粉末于试管中,并加入过量3mol•L-1 稀H2SO4,充分反应后,将上层清液分成两份 | (1)若有红色固体剩余,则假设2,3可能成立; (2)若无红色固体剩余,则假设1,3可能成立 |
| 若步骤1中有红色固体剩余; 步骤2:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液仍为蓝色,则假设2成立; |
| 若步骤1中有红色固体剩余; 步骤3:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液变为血红色,则假设3成立. |
| A. | H2O | B. | Cl2 | C. | NH4Cl | D. | NaOH |
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |

下列有关推断合理的是( )
| A. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 | |
| B. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ |
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
 .
. 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).