6.下列各物质中,互为同系物的是( )
| A. | CH3-CH2-CH2-CH3与 | B. | 醋酸和硬脂酸(C17H35COOH) | ||
| C. | 硝基苯和三硝基甲苯 | D. | CH3CH2Cl 和CH2ClCH2CH2Cl |
5.下列变化中,原物质分子内共价键被破坏,同时有离子键生成的是( )
| A. | 二氧化硅与氢氧化钠溶液 | B. | 氯化氢溶于水 | ||
| C. | 氯化氢与氨反应 | D. | 锌与稀硫酸反应 |
2.反应A+3B═2C+2D在四种不同的情况下的反应速率如下,最快的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(c)=0.4mol/(L•min) | D. | v(D)=0.45mol/(L•min) |
1.下列微粒中,电子数目最多的是( )
| A. | H2O | B. | NH3 | C. | Na+ | D. | Al |
20.已知R2+核外有X个电子,相对原子质量为M,这种元素所含的中子数是( )
| A. | M-X-2 | B. | M-X+2 | C. | X-2 | D. | M-2 |
19.下列各组化合物中化学键类型不同的是( )
| A. | H2O和NH3 | B. | CCl4和H2O2 | C. | CaO和KCl | D. | NaCl和HCl |
18.下列物质中的离子键最强的是( )
| A. | KCl | B. | CaCl2 | C. | MgO | D. | Na2O |
17.下列各元素原子排列中,其电负性减小顺序正确的是( )
0 168784 168792 168798 168802 168808 168810 168814 168820 168822 168828 168834 168838 168840 168844 168850 168852 168858 168862 168864 168868 168870 168874 168876 168878 168879 168880 168882 168883 168884 168886 168888 168892 168894 168898 168900 168904 168910 168912 168918 168922 168924 168928 168934 168940 168942 168948 168952 168954 168960 168964 168970 168978 203614
| A. | K>Li>Na | B. | F>O>S | C. | P>As>N | D. | C>O>N |
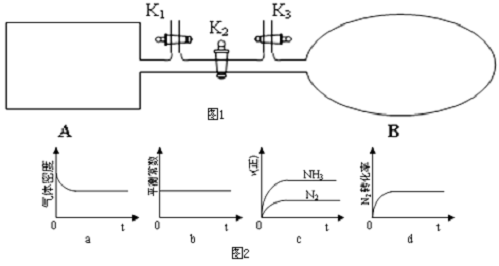
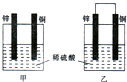 锌是一种较活泼的金属,具有广泛的用途.
锌是一种较活泼的金属,具有广泛的用途.