题目内容
2.反应A+3B═2C+2D在四种不同的情况下的反应速率如下,最快的是( )| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(c)=0.4mol/(L•min) | D. | v(D)=0.45mol/(L•min) |
分析 比较四种不同情况下反应速率的快慢,利用速率之比等于其化学计量数之比计算同一物质表示的速率进行比较.
解答 解:v(A):v(B):v(C):v(D)=1:3:2:2,转化为用A的浓度变化来表示的反应速率为:
A.v(A)=0.15 mol•L-1•min-1;
B.v(B)=0.01 mol•L-1•s-1×60 s•min-1=0.60 mol•L-1•min-1,则v(A)=$\frac{1}{3}$v(B)=0.20 mol•L-1•min-1;
C.v(C)=0.40 mol•L-1•min-1,则v(A)=$\frac{1}{2}$v(C)=0.20 mol•L-1•min-1;
D.v(D)=0.45 mol•L-1•min-1,则v(A)=$\frac{1}{2}$v(D)=0.225 mol•L-1•min-1,
故反应进行的快慢顺序为D>B=C>A,
故选D.
点评 本题考查化学反应速率快慢比较,为高频考点,把握速率与其化学计量数比值大小比较或转化为同一物质表示的速率比较为解答的关键,也可利用比值法比较,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.在一定温度下,反应A2(g)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 单位时间内生成n molA2同时生成n mol AB3 | |
| B. | 容器内的总物质的量不随时间变化 | |
| C. | 单位时间内生成2n mol AB3的同时生成n molB2 | |
| D. | 单位时间内生成n molA2的同时生成n molB2 |
13.下列物质的熔、沸点高低顺序不正确的是( )
| A. | F2<Cl2<Br2<I2 | B. | CF4>CCl4>CBr4>CI4 | ||
| C. | HCl<HBr<HI<HF | D. | CH4<SiH4<GeH4<SnH4 |
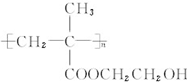
10.某有机物的结构如图所示,下列有关它的说法正确的是( )


| A. | 该有机物的分子式为:C10H9O5Br | |
| B. | 该有机物能发生银镜反应 | |
| C. | 1mol该有机物能与含3mol Br2的溴水发生加成反应 | |
| D. | 该有机物与热的NaOH溶液反应后有HOCH2COONa生成 |
17.下列各元素原子排列中,其电负性减小顺序正确的是( )
| A. | K>Li>Na | B. | F>O>S | C. | P>As>N | D. | C>O>N |
7.下列有关实验的说法中错误的是( )
| A. | 石蜡油分解产物中含有烯烃 | |
| B. | 直接蒸馏含杂质的工业乙醇不能得到无水乙醇 | |
| C. | 实验室用苯和溴水在溴化铁催化作用下制取溴苯 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应制取硝基苯 |
14.反应N2(g)+3H2(g)?2NH3(g),下列表示化学反应速率最快的是( )
| A. | v(N2)=0.40 mol•L-1•s-1 | B. | v(NH3)=1.20 mol•L-1•min-1 | ||
| C. | v(NH3)=0.60 mol•L-1•s-1 | D. | v(H2)=0.80 mol•L-1•s-1 |
17.下列物质中,只含极性共价键的化合物是( )
| A. | H2O | B. | Cl2 | C. | NH4Cl | D. | NaOH |
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
 .
.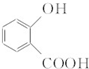 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).