题目内容
4.C、N、S是重要的非金属元素,按要求回答下列问题:(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学式为2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270 kJ•mol-1.
已知:CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1;S(s)+O2=SO2(g)△H=-296.0kJ•mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2SO2 (g)+O2 (g)?2SO3(g)△H<0.甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol.
则T1>T2(填“>”“<”),甲容器中反应的平衡常数K=108L•mol-1.
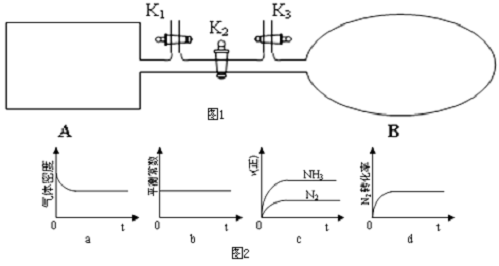
(3)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将1mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为N2(g)+3H2(g)?2NH3(g),起始时A、B的体积相同均为a L.
①图2示意图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是d.
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=$\frac{1}{at}$mol•L-1•S-1.
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为c1=c2<c3 (用c1、c2、c3和>、<、=表示).已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol•L-1,则该温度下0.1mol•L-1的NH4Cl溶液的pH为5.
分析 (1)已知①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
根据盖斯定律将方程式①×2-②得2CO(g)+SO2(g)=S(s)+2CO2(g),然后计算反应热;
(2)该反应为放热反应,温度越高,生成的SO3越少;先利用三段式求出平衡时各物质的浓度,再根据K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$计算;
(3)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
②已知反应为N2(g)+3H2(g)?2NH3(g),通入1mol N2和3mol H2,达到平衡后容器的压强变为原来的5/6,根据压强之比等于物质的量比结合三段式计算;
(4)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,氨气与硫酸和盐酸恰好反应;
醋酸铵溶液呈中性,则一水合氨和醋酸的电离常数相同,常温下CH3COOH的Ka=1×10-5 mol•L-1,所以NH3•H2O的电离常数为1×10-5 mol•L-1,Ka=$\frac{c(N{{H}_{4}}^{+})×c({H}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,Kh=$\frac{Kw}{Ka}$=1×10-9,据此计算.
解答 解:(1)①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=(-283.0KJ•mol-1)×2-(-296.0KJ•mol-1)=-270KJ•mol-1,
所以热化学反应方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270KJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270KJ•mol-1;
(2)该反应为放热反应,温度越高,生成的SO3越少,达到平衡时甲容器中生成的三氧化硫的物质的量少,则甲容器的温度高,即T1>T2;
2SO2 (g)+O2 (g)?2SO3(g)
起始(mol/L):5 3 0
转化(mol/L):x 0.5x x
平衡(mol/L):5-x 3-0.5x x
达到平衡时SO3的物质的量为4.5mol,则x=4.5mol/L,所以K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{4.{5}^{2}}{0.{5}^{2}×0.75}$=108L•mol-1;
故答案为:>;108L•mol-1;
(3)①a.密度=$\frac{总质量}{体积}$,总质量一定,A中体积不变,故密度不变,所以不能说明反应达到平衡状态,故a错误;
b.恒温条件下,平衡常数保持不变,则不能说明反应达到平衡状态,故b错误;
c.都是正反应速率,不能说明反应达到平衡状态,故c错误;
d.N2的转化率先增大,后保持不变,说明反应达到平衡状态,与图象相符,故d正确;
故答案为:d;
②
N2(g)+3H2(g)?2NH3(g)
起始(mol):1 3 0
转化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
达到平衡后容器的压强变为原来的$\frac{5}{6}$,则$\frac{4-2x}{4}$=$\frac{5}{6}$,解得x=$\frac{1}{3}$,
v(H2)=$\frac{\frac{1mol}{aL}}{ts}$=$\frac{1}{at}$mol•L-1•S-1;
故答案为:$\frac{1}{at}$mol•L-1•S-1;
(4)pH=1的醋酸中醋酸的浓度大于0.1mol/L,则通入0.1mol氨气反应后,醋酸有剩余,醋酸电离的氢离子能抑制铵根离子的电离,铵根离子浓度较大,氨气与硫酸和盐酸恰好反应,所以溶液中铵根离子浓度:c1=c2<c3,;
醋酸铵溶液呈中性,则一水合氨和醋酸的电离常数相同,常温下CH3COOH的Ka=1×10-5 mol•L-1,所以NH3•H2O的电离常数为1×10-5 mol•L-1,
Ka=$\frac{c(N{{H}_{4}}^{+})×c({H}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1×10-5,Kh=$\frac{Kw}{Ka}$=1×10-9,
设c(H+)为xmol/L,
则Kh=$\frac{{x}^{2}}{0.1}=1.0×1{0}^{-9}$,解得x=1×10-5mol/L,所以pH=5;
故答案为:c1=c2<c3;5.
点评 本题考查较综合,涉及平衡常数计算、反应速率计算、平衡状态判断、弱电解质的电离等知识点,这些都是高考高频点,侧重考查学生分析、计算及知识运用能力,注意只有反应前后改变的物理量才能作为平衡状态的判断依据,注意化学平衡常数计算中用物质浓度而不是物质的量计算,这些都是易错点.

| A. | 冰熔化时,分子中H-O键发生断裂 | |
| B. | HI比HF易分解,是因为HI分子间不存在氢键 | |
| C. | 非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 | |
| D. | 含有阴离子的物质一定含有阳离子 |
| A. | 不可将水直接倒入浓硫酸中进行稀释 | |
| B. | 浓硫酸可用于干燥O2、CO2 | |
| C. | 硝酸与铁反应可产生H2 | |
| D. | 浓硫酸对皮肤或衣服有很强的腐蚀性 |
| A. | 在Na2CO3的水溶液中存在:2c(Na+)=c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| B. | pH=3盐酸与pH=11氨水等体积混合时有:c(NH4+)=c(Cl-)>>c(H+)=c(OH-) | |
| C. | pH均为9的Na2CO3和CH3COONa溶液,二者的水解程度相同 | |
| D. | 在氨水中加水稀释,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ 增大 |
| A. | H2O和NH3 | B. | CCl4和H2O2 | C. | CaO和KCl | D. | NaCl和HCl |
| A. | 油脂没有固定的熔沸点 | |
| B. | 糖类都能发生水解反应 | |
| C. | 蛋白质溶液中加入浓盐酸颜色变黄 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质变性 |
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 物质燃烧反应都是放热反应 | |
| C. | 酸碱中和反应可能是吸热反应 | |
| D. | 放热反应不要加热就能发生反应 |
| A. | 纯碱属于碱 | B. | 钢属于纯净物 | ||
| C. | 冰醋酸属于混合物 | D. | 水属于氧化物 |