9.下列离子方程式正确的是( )
| A. | 氨水与亚硫酸溶液混合:NH3•H2O+H+═NH4++H2O | |
| B. | 将少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=2HClO+CaSO3↓ | |
| C. | 足量铁屑溶于稀硫酸:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 将Cl2通入FeSO4溶液中:Cl2+2Fe2+═2Fe3++2 Cl- |
8.理论上不能设计为原电池的化学反应是( )
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | HNO3+NaOH═NaNO3+H2O | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2FeCl3+Fe═3FeCl2 |
7. 火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL2mol•L-1的NaOH溶液中通入标准状况下4.48LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是abd(填字母序号).
a.c(HSO3-)>c(SO32-)>c(H2SO3)
b.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
d.c(H+)=c(SO32-)-c(H2SO3)+c(OH-)
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
①在阳极区发生的反应中的非氧化还原反应的离子方程式为4OH--4e-═2H2O+O2↑.
②简述CO32-在阴极区再生的原理HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生.
(3)下表中列出了25℃、l0l kPa时一些物质的燃烧热数据:
已知键能:C-H键:413.4kJ.mol-l.H-H键:436.0kJ•mol-1,请计算:
①2CH4(g)=C2H2(g)+3H2(g)△H=376.4 kJ•mol-1
②C2H2中-C≡C-的键能为796.0 kJ/molkJ•mol-l
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为CH4+4CO32--8e-=5CO2+2H2O.
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是CO2.
 火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL2mol•L-1的NaOH溶液中通入标准状况下4.48LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是abd(填字母序号).
a.c(HSO3-)>c(SO32-)>c(H2SO3)
b.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
d.c(H+)=c(SO32-)-c(H2SO3)+c(OH-)
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
①在阳极区发生的反应中的非氧化还原反应的离子方程式为4OH--4e-═2H2O+O2↑.
②简述CO32-在阴极区再生的原理HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生.
(3)下表中列出了25℃、l0l kPa时一些物质的燃烧热数据:
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ•mol-1 | 890.3 | 1299.6 | 285.8 |
①2CH4(g)=C2H2(g)+3H2(g)△H=376.4 kJ•mol-1
②C2H2中-C≡C-的键能为796.0 kJ/molkJ•mol-l
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为CH4+4CO32--8e-=5CO2+2H2O.
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是CO2.
4. 非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题.
非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题.
(1)①O2-的核外电子排布式为1s22s22p6,CS2的晶体类型为分子 晶体,其C的轨道杂化方式为sp
②CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子间能形成氢键、乙烷分子间不能形成氢键;
(2)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O═SO42-+2Cl-+3H+.
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于$\frac{1}{2}$
(3)室温时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.
试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
0 168756 168764 168770 168774 168780 168782 168786 168792 168794 168800 168806 168810 168812 168816 168822 168824 168830 168834 168836 168840 168842 168846 168848 168850 168851 168852 168854 168855 168856 168858 168860 168864 168866 168870 168872 168876 168882 168884 168890 168894 168896 168900 168906 168912 168914 168920 168924 168926 168932 168936 168942 168950 203614
 非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题.
非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题.(1)①O2-的核外电子排布式为1s22s22p6,CS2的晶体类型为分子 晶体,其C的轨道杂化方式为sp
②CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子间能形成氢键、乙烷分子间不能形成氢键;
(2)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于$\frac{1}{2}$
(3)室温时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.
试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
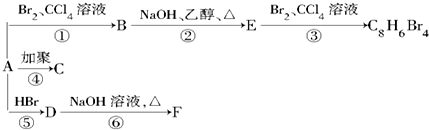
 ,D
,D ,E
,E ,
, +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$
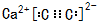 ,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2
,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2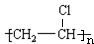 .
.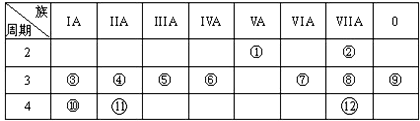
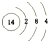 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式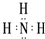 .
.
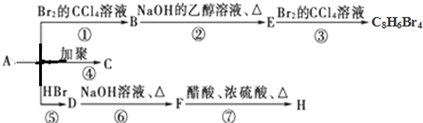
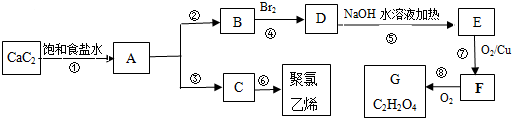
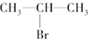 (主要产物)
(主要产物)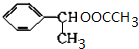 ,
,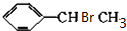 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$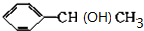 +NaBr.
+NaBr.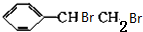 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$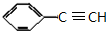 +2NaBr+2H2O
+2NaBr+2H2O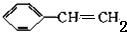 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$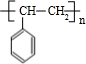 .
. ;
;