题目内容
7. 火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.
火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害.对烟气中CO2、CO、SO2等物质进行回收利用意义重大.(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL2mol•L-1的NaOH溶液中通入标准状况下4.48LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是abd(填字母序号).
a.c(HSO3-)>c(SO32-)>c(H2SO3)
b.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
d.c(H+)=c(SO32-)-c(H2SO3)+c(OH-)
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
①在阳极区发生的反应中的非氧化还原反应的离子方程式为4OH--4e-═2H2O+O2↑.
②简述CO32-在阴极区再生的原理HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生.
(3)下表中列出了25℃、l0l kPa时一些物质的燃烧热数据:
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ•mol-1 | 890.3 | 1299.6 | 285.8 |
①2CH4(g)=C2H2(g)+3H2(g)△H=376.4 kJ•mol-1
②C2H2中-C≡C-的键能为796.0 kJ/molkJ•mol-l
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为CH4+4CO32--8e-=5CO2+2H2O.
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是CO2.
分析 (1)n(SO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH)=0.1L×2mol/L=0.2mol,二者反应的化学方程式为:SO2+NaOH=NaHSO3,反应后测得溶液pH<7,NaHSO3溶液呈酸性,说明HSO3-电离程度大于水解程度,结合溶液的电中性原则、物料守恒以及质子守恒解答该题;
(2)①阳极上氢氧根离子放电生成氧气;
②碳酸氢根离子程度电离平衡、氢氧根离子和碳酸氢根离子反应生成碳酸根离子;
(3)①由CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H3=-890.3kJ/mol①,C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1299.6 kJ/mol②,H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol③,依据②+③×3-①×2可得:C2H2(g)+3H2(g)═2CH4(g)△H=-376.4 kJ/mol,根据盖斯定律计算反应的焓变;
②依据化学反应的焓变=反应物总键能-生成物的总键能;
(4)燃料电池中,负极发生的反应一定是燃料失去电子的过程,电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳.
解答 解:(1)n(SO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH)=0.1L×2mol/L=0.2mol,二者反应的化学方程式为:SO2+NaOH=NaHSO3,
a、亚硫酸是弱酸,反应后测得溶液pH<7,NaHSO3溶液呈酸性,说明HSO3-电离程度大于水解程度,即c(SO32-)>c(H2SO3),NaHSO3溶液是盐溶液,电离出钠离子和亚硫酸氢根离子,HSO3-电离和水解程度相对于亚硫酸钠的电离都比较小,所以c(HSO3-)>c(SO32-)>c(H2SO3),故a正确;
b、NaHSO3溶液是盐溶液,电离出钠离子和亚硫酸氢根离子,因HSO3-电离和水解,所以c(Na+)>c(HSO3-),NaHSO3溶液pH<7,所以c(H+)>c(SO32-),故
b正确;
c、溶液中一定存在电荷守恒,阳离子所带的正电荷总数等于阴离子所带的负电荷总数即:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故c错误;
d、根据质子守恒,c(H+)=c(SO32-)-c(H2SO3)+c(OH-),故d正确.
故答案为:abd;
(2)①阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
②HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生,
故答案为:HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生;
(3)①由CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H3=-890.3kJ/mol①,C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1299.6 kJ/mol②,H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol③,依据②+③×3-①×2可得:C2H2(g)+3H2(g)═2CH4(g)△H=-376.4 kJ/mol,则 2CH4(g)═C2H2(g)+3H2(g)△H=+376.4 kJ•mol-1,故答案为:+376.4 kJ•mol-1;
②根据2CH4(g)═C2H2(g)+3H2(g)△H=+376.4 kJ•mol-1,△H=反应物总键能-生成物总键能=C≡C键的键能+2×413.4kJ/mol+3×436.0kJ/mol-8×413.4kJ/mol=-376.4KJ/mol,则C≡C键的键能=796.0 kJ/mol,故答案为:796.0 kJ/mol;
(4)燃料电池中,负极发生的反应一定是燃料失去电子的过程,该电池的电解质环境是熔融碳酸盐,所以电极反应为:CH4+4CO32--8e-=5CO2+2H2O,电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳(CO2),故答案为:CH4+4CO32--8e-=5CO2+2H2O;CO2.
点评 本题主要考查了溶液中离子浓度大小比较、燃烧热的应用以及燃料电池和电解池的工作原理知识,掌握燃烧热的定义和盖斯定律的运用、明确原电池和电解池的工作原理是关键,题目难度中等.

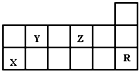
| A. | 热稳定性:Y的气态氢化物<Z的气态氢化物 | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R元素的单质化学性质活泼 |
| A. | HCl十NaOH=NaCl十H2O | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | CaO十H2O=Ca(OH)2 |
(1)v(A)=0.3mol/(L•s )
(2)v(B)=0.6mol/(L•s)
(3)v(C)=0.4mol/(L•s)
(4)v(D)=0.45mol/(L•s)
| A. | (4)>(1)>(2)=(3) | B. | (2)>(1)>(4)=(3) | C. | (1)>(4)>(2)=(3) | D. | (3)>(4)>(2)=(1) |
| A. | 常温下,0.1 mol/L的下列溶液①NH4Al(SO4)2;②NH4Cl;③NH3•H2O;④CH3COONH4⑤(NH4)2SO4中,c(NH4+)由大到小的顺序是:⑤>②>①>④>③ | |
| B. | 常温下,0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 常温下,将CH3COONa、HCl两溶液混合后,溶液呈中性,溶液中c(Na+)大于c(Cl-) | |
| D. | pH相等的下列溶液:a.CH3COOK、b.NaHCO3、c.Na2CO3、d.NaOH,其物质的量浓度由小到大顺序为:d<c<a<b |
| A. | N2的结构式::N≡N: | B. | F-离子结构示意图: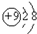 | ||
| C. | 用电子式表示HCl形成过程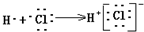 | D. | 次氯酸电子式 |
| A. | 0.1mol•L-1Fe(NO3)2溶液:Mg2+、H+、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$、Na+ | |
| C. | Na2O2溶于水产生O2:2O22-+2H2O═O2↑+4OH- | |
| D. | 用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
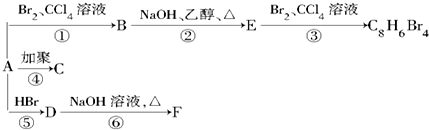
 ,D
,D ,E
,E ,
, +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$