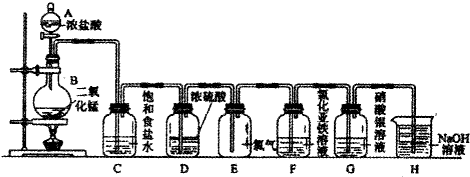
题目内容
6.用图所示的装置进行电解,通电一会儿,发现湿润的淀粉-KI试纸的C端变蓝色,则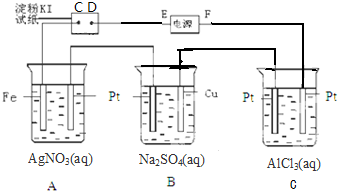
(1)E为负极,A中Pt电极上得电极反应方程式为4OH--4e-═O2+2H2O
C中发生反应的化学方程式为2AlCl3+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3Cl2↑+3H2↑
(2)在B中出现的现象是铂丝极有气泡产生,Cu极周围变蓝色,溶液中有蓝色沉淀生成.
(3)室温下,若从电解开始到时间ts,A、B装置中共收集到气体0.168L(标准状况下).若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰好为1000mL,则A溶液中pH为2.
分析 (1)通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明C端是阳极,则E是负极,F是正极,A中铁作阴极,铂丝作阳极,电解硝酸银溶液时,阴极上银离子放电,阳极上氢氧根离子放电;C中电解氯化铝溶液,阳极氯离子失电子放出氯气,阴极上氢离子放电,据此书写;
(2)电解硫酸钠溶液,铜作阳极,铂丝作阴极,阳极上铜失电子发生氧化反应,阴极上氢离子放电;
(3)根据转移电子守恒进行解答.
解答 解:(1)通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明C端是阳极,则E是负极,F是正极,A中铁作阴极,铂丝作阳极,电解硝酸银溶液时,阴极上银离子放电,阳极上氢氧根离子放电,反应式为4OH--4e-═O2+2H2O;C中电解氯化铝溶液,阳极氯离子失电子放出氯气,阴极上氢离子放电,电解方程式为2AlCl3+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3Cl2↑+3H2↑,
故答案为:负;4OH--4e-═O2+2H2O;2AlCl3+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3Cl2↑+3H2↑;
(2)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,Cu极周围变蓝色,阴极生成氢气,溶液生成氢氧化铜沉淀,
故答案为:铂丝极有气泡产生;Cu极周围变蓝色; 溶液中有蓝色沉淀生成;
(3)A、B装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L×$\frac{1}{3}$=0.056L,n(02)=$\frac{0.056L}{22.4L/mol}$=0.0025mol,转移电子0.01mol,
A中盛有AgNO3溶液,电解时生成硝酸,n(H+)=n(e-)=0.01mol,则c(H+)=$\frac{0.01mol}{1L}$=0.01mol/L,则pH=2,
故答案为:2.
点评 本题综合考查电解原理,侧重于考查学生综合运用电解知识的能力,题目难度较大,注意把握电解规律,能正确判断电极方程式.

 阅读快车系列答案
阅读快车系列答案| A. | v(O2):v(SO2)=1:2 | B. | 各物质浓度相等 | ||
| C. | c(SO2)保持不变 | D. | c(SO2):c(O2):c(S03)=2:1:2 |
| A. | NO 0.001 mol•L-1 | B. | H2O 0.002 mol•L-1 | ||
| C. | NH3 0.002 mol•L-1 | D. | O2 0.0025 mol•L-1 |
 、⑤ClCH=CHCl、
、⑤ClCH=CHCl、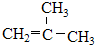 、⑦
、⑦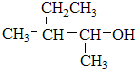 、⑧
、⑧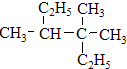 、⑨
、⑨
 .
. .
.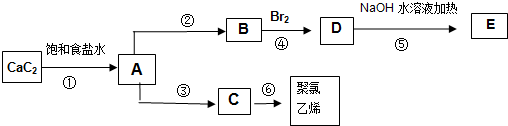
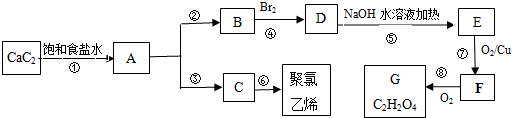
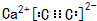 ,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2
,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2 .
.