题目内容
10.如图是元素周期表的一部分,回答下列有关问题: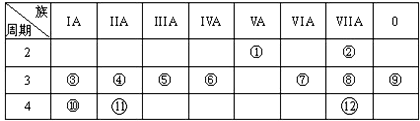
(1)画出⑥的原子结构示意图:
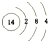 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式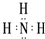 .
.(2)元素④、⑩、⑪的最高价氧化物水化物的碱性最强的为KOH;元素②、⑦、⑧的氢化物稳定性由弱到强的顺序为HF>HCl>H2S(均用化学式填空).
(3)③与氧形成的化合物R2O2中所含化学键类型为离子键、共价键.
(4)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能发生反应,写出其化学反应方程式 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
分析 (1)由位置可知,⑥为Si,①为N,N的氢化物为NH3;
(2)④、⑩、⑪分别为Mg、K、Ca,金属性越强,最高价氧化物水化物的碱性越强;②、⑦、⑧分别为F、S、Cl,非金属性越强,氢化物稳定性越强;
(3)③与氧形成的化合物R2O2为Na2O2;
(4)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,则A为C,与⑦的最高价氧化物的水化物浓溶液在加热时能发生反应,生成二氧化碳、二氧化硫和水.
解答 解:(1)由位置可知,⑥为Si,其原子结构示意图为 ;①为N,N的氢化物为NH3,其电子式为
;①为N,N的氢化物为NH3,其电子式为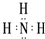 ,故答案为:
,故答案为: ;
;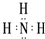 ;
;
(2)④、⑩、⑪分别为Mg、K、Ca,金属性K>Ca>Mg,则最高价氧化物水化物的碱性最强的为KOH;②、⑦、⑧分别为F、S、Cl,非金属性F>Cl>S,氢化物稳定性由弱到强的顺序为HF>HCl>H2S,故答案为:KOH;HF>HCl>H2S;
(3)③与氧形成的化合物R2O2为Na2O2;,含钠离子与过氧根离子之间的离子键及O-O共价键,故答案为:离子键、共价键;
(4)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,则A为C,与⑦的最高价氧化物的水化物浓溶液在加热时能发生反应,生成二氧化碳、二氧化硫和水,该反应为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、元素周期律及元素化合物知识为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.

| A. | Fe2+、Na+、Cl-、SCN- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Al3+、Na+、Cl-、NH3•H2O |
| A. | 离子半径:O2->Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4<H2SO4 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失 | |
| C. | 锥形瓶用蒸馏水洗,未用待测液润洗 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
| A. | 加入适量NaNO3溶液 | B. | 加入适量NaOH溶液 | ||
| C. | 加入适量Na2CO3溶液 | D. | 加入适量NaCl溶液 |
 Na2O2
Na2O2
 →
→ 、MgCl2
、MgCl2 .
.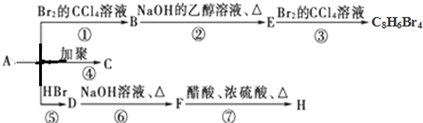
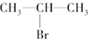 (主要产物)
(主要产物)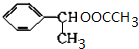 ,
,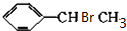 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$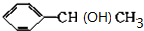 +NaBr.
+NaBr.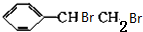 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$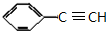 +2NaBr+2H2O
+2NaBr+2H2O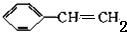 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$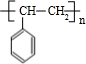 .
.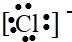 ,C.H2O
,C.H2O ,D.Na2O2
,D.Na2O2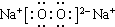 ,
, ;MgCl2
;MgCl2 .
.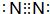 ;B的原子在周期表中的位置是第三周期ⅡA族
;B的原子在周期表中的位置是第三周期ⅡA族