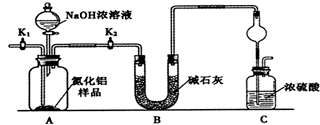
9.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 将10ml0.1mol•L-1Na2CO3溶液逐滴滴加到10ml0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | |
| B. | 若将CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N前<N后 |
8.金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可采用电解其熔融物法回收锂而循环使用.其工作示意图如右图,下列说法不正确的是( )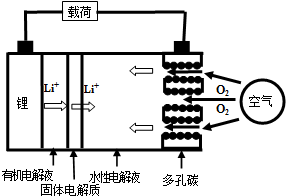

| A. | 放电时负极的电极反应式为:Li-e-=Li+ | |
| B. | 熔融的氢氧化锂用惰性电极电解再生时,金属锂在阴极得到 | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 放电时,正极的电极反应式为:2H2O+O2+4e-=4OH- |
7.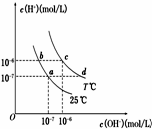 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:Fe3+、Ba2+、K+、NO3- | |
| B. | b点对应的溶液中大量存在:Na+、K+、NH4+、Cl- | |
| C. | d点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | c点对应的溶液中大量存在:CO32-、Na+、Cu2+、SO42- |
6.微粒甲与离子乙在溶液中的转化关系如图所示: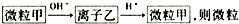 ,则甲是( )
,则甲是( )
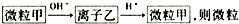 ,则甲是( )
,则甲是( )| A. | Fe2+ | B. | Mg2+ | C. | Al | D. | CO2 |
4.下列化学用语正确的是( )
| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 四氯化碳的比例模型  | |
| C. | 氧原子的电子排布图  | |
| D. | ${\;}_{8}^{16}$O2-离子的结构示意图: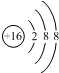 |
3.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5;④1s22s22p63s23p2则下列有关比较中正确的是( )
0 168728 168736 168742 168746 168752 168754 168758 168764 168766 168772 168778 168782 168784 168788 168794 168796 168802 168806 168808 168812 168814 168818 168820 168822 168823 168824 168826 168827 168828 168830 168832 168836 168838 168842 168844 168848 168854 168856 168862 168866 168868 168872 168878 168884 168886 168892 168896 168898 168904 168908 168914 168922 203614
| A. | 第一电离能:③>②>④>① | B. | 原子半径:①>②>④>③ | ||
| C. | 电负性:③>①>②>④ | D. | 最高正化合价:③>①>②>④ |
 在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g
在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g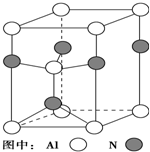 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、氮化硼、磷化硼和砷化镓属于此列,如氮化铝晶体晶胞如右图所示
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、氮化硼、磷化硼和砷化镓属于此列,如氮化铝晶体晶胞如右图所示