题目内容
4.下列化学用语正确的是( )| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 四氯化碳的比例模型  | |
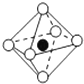
| C. | 氧原子的电子排布图  | |
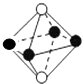
| D. | ${\;}_{8}^{16}$O2-离子的结构示意图: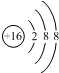 |
分析 A.碳酸为二元弱酸,其电离过程分步进行,电离方程式分步书写;
B.四氯化碳中,C原子的原子半径小于氯原子;
C.氧原子的核电荷数=核外电子总数=8,据此写出其核外电子排布图;
D.氧离子的核电荷数为8,核外电子总数为10.
解答 解:A.H2CO3是二元弱酸,电离分步进行,主要以第一步为主,其正确的电离方程式为:H2CO3?H++HCO3-、HCO3-?H++CO32-,故A错误;
B.四氯化碳分子中,氯原子的原子半径大于碳原子,则比例模型中氯原子的相对体积大于碳原子,其正确的比例模型为: ,故B错误;
,故B错误;
C.氧原子的核外电子总数为8,其电子排布图为: ,故C正确;
,故C正确;
D.该氧离子的核电荷数为8、核外电子总数是10,其正确的离子结构示意图为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的书写判断,题目难度中等,涉及比例模型、电子排布图、离子结构示意图、电离方程式等知识,熟练掌握常见化学用语的书写原则为解答关键,试题侧重考查学生的规范答题能力.

练习册系列答案
相关题目
9.制备Fe3O4纳米颗粒的化学方程式为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+X+2H2O.下列有关说法不正确的是( )
| A. | 上式中的X为S4O62- | |
| B. | 该反应中的还原剂为Fe2+和S2O32- | |
| C. | 当3 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1 mol | |
| D. | 当生成1 mol Fe3O4时,转移电子的物质的量为4 mol |
14.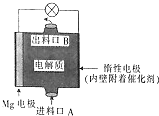 镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
 镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )| A. | 惰性电极是该电池的正极 | |
| B. | 电解质中的多数ClO-向电池的负极移动 | |
| C. | 电池中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 进料口A进入的是NaClO溶液,而出料口B输出的则是NaCl溶液 |
9.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 将10ml0.1mol•L-1Na2CO3溶液逐滴滴加到10ml0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | |
| B. | 若将CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N前<N后 |
16.解释下列物质性质的变化规律时,与共价键的键能无关的是( )
| A. | N2比P4的化学性质稳定 | |
| B. | F2、C12、Br2、I2的沸点逐渐升高 | |
| C. | 金刚石的熔点比晶体硅高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
13.有机物分子间或原子与原子团间的相互影响会导致物质化学物质的不同,下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 酚和醇的羟基性质差别较大 |