题目内容
9.下列溶液中微粒的物质的量浓度关系不正确的是( )| A. | 将10ml0.1mol•L-1Na2CO3溶液逐滴滴加到10ml0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | |
| B. | 若将CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N前<N后 |
分析 A.将10ml0.1mol•L-1Na2CO3溶液逐滴滴加到10ml0.1mol•L-1盐酸中,最终得到碳酸钠和氯化钠;
B.溶液为中性,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=2c(CO32-)+c(HCO3-)=0.2mol/L;
C.硫酸为强酸,若BOH为强电解质,则混合液为中性,若BOH为弱碱,混合液呈碱性;
D.次氯酸钠发生水解,溶液呈碱性,而氯化钠不水解,则次氯酸钠中的氢离子浓度小于氯化钠,再结合电荷守恒判断溶液中离子总数大小.
解答 解:A.将10ml0.1mol•L-1Na2CO3溶液逐滴滴加到10ml0.1mol•L-1盐酸中,碳酸钠与过量盐酸反应生成氯化钠、二氧化碳气体和水,最终得到氯化钠和碳酸钠的混合物,钠离子、氯离子不水解,碳酸根离子部分水解,则离子浓度大小为:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-),故A正确;
B.若将CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=2c(CO32-)+c(HCO3-)=0.2mol/L,故B错误;
C.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,当BOH为强电解质时,二者恰好反应,混合液为中性,当BOH为弱电解质时,混合液中碱过量,反应后的溶液为碱性,故所得溶液可能为中性也可能为碱性,故C正确;
D.HClO是弱酸,NaClO溶液中次氯酸根离子发生水解反应:ClO-+H2O?HClO+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中c(Na+)+c(H+)大于NaClO溶液中c(Na+)+c(H+),根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)可得溶液中离子总数为2×[c(Na+)+c(H+)]×V;同理可得NaClO溶液中总数为2×[c(Na+)+c(H+)]×V,所以NaCl溶液中离子总数大于NaClO溶液,故D正确;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,注意掌握电荷守恒、物料守恒及盐的水解原理,A为易错点,注意滴加碳酸钠的过程中,氢离子过量,最终得到的不是碳酸氢钠溶液,试题培养了学生的分析能力及灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 四氯化碳的比例模型  | |
| C. | 氧原子的电子排布图  | |
| D. | ${\;}_{8}^{16}$O2-离子的结构示意图: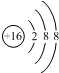 |
| A. | 金刚石 | B. | 氟化镁 | C. | 冰醋酸 | D. | 金属钾 |
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )| A. | a为正极是金属铜,b为负极是金属锌 | |
| B. | a极上H+得到电子,发生氧化反应 | |
| C. | b极金属发生反应(或称被腐蚀),发生氧化反应 | |
| D. | 该装置将化学能转变为电能 |
| A. | 离子化合物中一定只含离子键 | |
| B. | 共价化合物中一定只含共价键 | |
| C. | 离子化合物中不一定含有金属元素 | |
| D. | 共价键不一定只存在于共价化合物中 |
| A. | 氯化钠的电子式: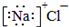 | B. | 氯化氢的电子式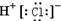 | ||
| C. | 碳元素位于周期表中第2周期ⅥA族 | D. | H2O的结构式:H-O-H |
 H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题

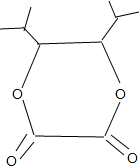 +2H2O;
+2H2O; ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.