17. 乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
 乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )| A. | 与金属钠作用时,键①断 | |
| B. | 浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和④断裂 |
16.美国营养师布鲁索拿麦当劳“快乐儿童餐”做了个实验,结果发现购买的汉堡和薯条在一年内仍不变质,于是他指责麦当劳食品防腐剂太多.丙酸钠是常用的防腐剂之一,该物质可以由丙酸和烧碱反应制得.下列有关丙酸的说法不正确的是( )
| A. | 丙酸遇紫色石蕊试剂变红 | B. | 丙酸与乙醇的酯化反应是取代反应 | ||
| C. | 丙酸和乙酸互为同系物 | D. | 丙酸存在多种羧酸类同分异构体 |
15.2006年10月18日《钱江晚报》报道:美国劳伦斯-利弗莫尔国家实验室16日宣布,美国与俄罗斯科学家合作,成功地合成了3个118号超重元素原子并观察到其存在.这种超重元素只能持续存在极短的时间,约有0.9毫秒,之后即迅速衰变为原子量较小的其他元素.下列有关说法正确的是( )
| A. | 118号元素属于第八周期元素 | |
| B. | 118号元素是一种金属元素 | |
| C. | 118号元素的原子核中含有118个质子 | |
| D. | 118号元素原子经化学反应后可转化成其他元素的原子 |
13. 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.
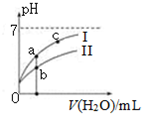
右图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
12.下列离子方程式正确的是( )
| A. | 草酸可使酸性高锰酸钾溶液褪色,其离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O | |
| B. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O | |
| C. | NaHSO3溶液与FeCl3反应的离子方程式:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+ | |
| D. | NH4HCO3溶液中加入少量NaOH:NH4++OH-═NH3•H2O |
11.分类是化学学习和研学的常用手段.下列分类依据和结论正确的是( )
| A. | 纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物 | |
| B. | HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 经分析某物质只含有一种元素,则该物质一定是纯净物 | |
| D. | 金属氧化物一定是碱性氧化物 |
9.制备Fe3O4纳米颗粒的化学方程式为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+X+2H2O.下列有关说法不正确的是( )
0 168721 168729 168735 168739 168745 168747 168751 168757 168759 168765 168771 168775 168777 168781 168787 168789 168795 168799 168801 168805 168807 168811 168813 168815 168816 168817 168819 168820 168821 168823 168825 168829 168831 168835 168837 168841 168847 168849 168855 168859 168861 168865 168871 168877 168879 168885 168889 168891 168897 168901 168907 168915 203614
| A. | 上式中的X为S4O62- | |
| B. | 该反应中的还原剂为Fe2+和S2O32- | |
| C. | 当3 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1 mol | |
| D. | 当生成1 mol Fe3O4时,转移电子的物质的量为4 mol |
 H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
 .
.