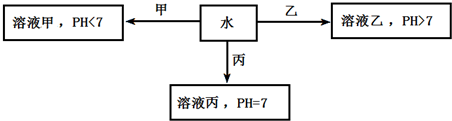
题目内容
11.分类是化学学习和研学的常用手段.下列分类依据和结论正确的是( )| A. | 纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物 | |
| B. | HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 经分析某物质只含有一种元素,则该物质一定是纯净物 | |
| D. | 金属氧化物一定是碱性氧化物 |
分析 A、由金属盒非金属元素形成的化合物绝大多数是离子化合物;
B、HCl和稀硫酸无强氧化性;
C、只由一种物质构成的是纯净物;
D、金属氧化物不一定是碱性氧化物.
解答 解:A、由金属盒非金属元素形成的化合物绝大多数是离子化合物(AlCl3除外),铵盐也是离子化合物,故纯碱、Na2O2、NH4NO3、Ca(OH)2均离子化合物,故A正确;
B、HCl和稀硫酸无强氧化性,不是氧化性酸,故B错误;
C、只由一种物质构成的才是纯净物,如O2和O3的混合物,虽然只由一种元素构成,但是混合物,故C错误;
D、金属氧化物不一定是碱性氧化物,如Al2O3为两性氧化物,故D错误.
故选A.
点评 本题考查了离子化合物的判断、强氧化性酸的记忆以及金属氧化物和碱性氧化物之间的关系,应注意的是金属氧化物不一定是碱性氧化物,但碱性氧化物一定是金属氧化物.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.短周期元素A、B、C、D的原子序数依次增大,它们原子的最外层电子数之和为16,A与D同主族,B+与A2-具有相同的电子层结构,C原子的最外层电子数等于A原子最外层电子数的一半,则下列叙述正确的是( )
| A. | B2A2和B2A中阴阳离子的个数比相同 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | D的简单气态氢化物的热稳定性比A的强 | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
16.美国营养师布鲁索拿麦当劳“快乐儿童餐”做了个实验,结果发现购买的汉堡和薯条在一年内仍不变质,于是他指责麦当劳食品防腐剂太多.丙酸钠是常用的防腐剂之一,该物质可以由丙酸和烧碱反应制得.下列有关丙酸的说法不正确的是( )
| A. | 丙酸遇紫色石蕊试剂变红 | B. | 丙酸与乙醇的酯化反应是取代反应 | ||
| C. | 丙酸和乙酸互为同系物 | D. | 丙酸存在多种羧酸类同分异构体 |
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1mol•L-1的Na2S溶液中,S2-的数目小于0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2L甲醇中含有的分子数目为0.5NA | |
| D. | 0.1mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3NA |
6.微粒甲与离子乙在溶液中的转化关系如图所示: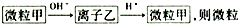 ,则甲是( )
,则甲是( )
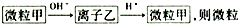 ,则甲是( )
,则甲是( )| A. | Fe2+ | B. | Mg2+ | C. | Al | D. | CO2 |
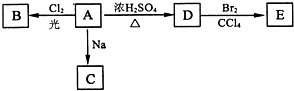
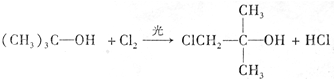 ;A转化为D的反应的类型消去反应.
;A转化为D的反应的类型消去反应.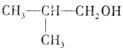 .
.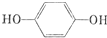 .
.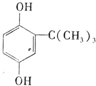 .
.
 (R、R′代表烃基)
(R、R′代表烃基)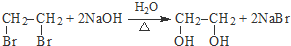 .
.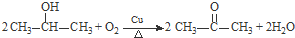 .
.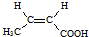 .
. .
.