题目内容
16.美国营养师布鲁索拿麦当劳“快乐儿童餐”做了个实验,结果发现购买的汉堡和薯条在一年内仍不变质,于是他指责麦当劳食品防腐剂太多.丙酸钠是常用的防腐剂之一,该物质可以由丙酸和烧碱反应制得.下列有关丙酸的说法不正确的是( )| A. | 丙酸遇紫色石蕊试剂变红 | B. | 丙酸与乙醇的酯化反应是取代反应 | ||
| C. | 丙酸和乙酸互为同系物 | D. | 丙酸存在多种羧酸类同分异构体 |
分析 丙酸结构简式为CH3CH2COOH,含有羧基,具有羧酸性质,
A.丙酸属于酸,能使紫色石蕊试液变红色;
B.酯化反应都是取代反应;
C.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物;
D.羧酸不存在羧酸类同分异构体.
解答 解:A.丙酸属于酸,能电离出氢离子而能使紫色石蕊试液变红色,故A正确;
B.酯化反应都是取代反应,所以丙酸和乙醇的酯化反应属于取代反应,故B正确;
C.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物,丙酸和乙酸相差一个-CH2原子团,所以属于同系物,故C正确;
D.羧酸不存在羧酸类同分异构体,但含有酯类同分异构体,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系及基本概念即可解答,注意酯的水解反应、酯化反应都属于取代反应,易错选项是D.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6. 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
(1)以浓硫酸为电解质,按如图装置实验,小灯泡昏暗.请写出浓硫酸的电离方程式H2SO4?H++HSO4-或2H2SO4?H3SO4++HSO4-;向硫酸中撒入硫酸钡细粉,灯泡会渐渐明亮起来.用化学方程式表示增亮的原因BaSO4+H2SO4=Ba2++2HSO4-.
(2)重晶石直接开发利率很难,目前主要是通过两种途径进行开发:
一是把重晶石碾碎撒入饱和碳酸钠溶液中,不停搅拌,尔后过滤,将滤渣投入相应的酸中溶解,转化为相应的水溶性钡盐.用离子方程式表示碳酸钠溶液溶蚀硫酸钡的原理CO32-+BaSO4?BaCO3+SO42-;
其二是高温热还原:BaSO4+4C═BaS+4CO …①
BaSO4+4H2═BaS+4H2O …②.试比较①②两种还原开发的优劣①原料易得,成本低,不足之处是原料原料率不高,污染严重;
②原料利用率高,不足之处是成本高,有副反应发生,产品纯度低;.CO能不能还原硫酸钡?若认为不能,请说明理由,若能,你认为应该如何促使反应顺利进行,写出反应方程式.BaS热水中易水解,生成的H2S受热分解,BaSO4+4CO=BaS+4CO2
②中氢可利用炼油中的重油CxHy催化氧化还原获得.其反应思路式为:2CxHy+4xH2O?2xCO2+y+4xH2,配平该反应方程式;指出氧化剂水、CxHy;还原剂CxHy.
(3)已知:
①正向反应的反应热△H>0(“>”“<”“=”);
②较理想的反应温度应该控制在500℃.
(4)请运用你所学知识,设计一个新的开发重晶石方案BaSO4+4H2=BaS+4H2O[利用生物催化剂,利用厌氧硫化菌].
(5)从理论上讲CxHy+H2O→CO2+H2的反应是一个焓增、熵增反应(从反应原理角度回答);该反应的逆向反应:CO2+H2→CxHy+H2O开发意义重大,你认为最需要解决的两大问题分别是①利用绿色能源、②寻找理想催化剂(生物催化剂).
 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.(1)以浓硫酸为电解质,按如图装置实验,小灯泡昏暗.请写出浓硫酸的电离方程式H2SO4?H++HSO4-或2H2SO4?H3SO4++HSO4-;向硫酸中撒入硫酸钡细粉,灯泡会渐渐明亮起来.用化学方程式表示增亮的原因BaSO4+H2SO4=Ba2++2HSO4-.
(2)重晶石直接开发利率很难,目前主要是通过两种途径进行开发:
一是把重晶石碾碎撒入饱和碳酸钠溶液中,不停搅拌,尔后过滤,将滤渣投入相应的酸中溶解,转化为相应的水溶性钡盐.用离子方程式表示碳酸钠溶液溶蚀硫酸钡的原理CO32-+BaSO4?BaCO3+SO42-;
其二是高温热还原:BaSO4+4C═BaS+4CO …①
BaSO4+4H2═BaS+4H2O …②.试比较①②两种还原开发的优劣①原料易得,成本低,不足之处是原料原料率不高,污染严重;
②原料利用率高,不足之处是成本高,有副反应发生,产品纯度低;.CO能不能还原硫酸钡?若认为不能,请说明理由,若能,你认为应该如何促使反应顺利进行,写出反应方程式.BaS热水中易水解,生成的H2S受热分解,BaSO4+4CO=BaS+4CO2
②中氢可利用炼油中的重油CxHy催化氧化还原获得.其反应思路式为:2CxHy+4xH2O?2xCO2+y+4xH2,配平该反应方程式;指出氧化剂水、CxHy;还原剂CxHy.
(3)已知:
| 反应温度 | 300℃ | 400℃ | 500℃ | 600℃ | 700℃ |
| 平衡常数 | 3.8 | 5.7 | 8.5 | 9.2 | 9.8 |
②较理想的反应温度应该控制在500℃.
(4)请运用你所学知识,设计一个新的开发重晶石方案BaSO4+4H2=BaS+4H2O[利用生物催化剂,利用厌氧硫化菌].
(5)从理论上讲CxHy+H2O→CO2+H2的反应是一个焓增、熵增反应(从反应原理角度回答);该反应的逆向反应:CO2+H2→CxHy+H2O开发意义重大,你认为最需要解决的两大问题分别是①利用绿色能源、②寻找理想催化剂(生物催化剂).
4.下列说法错误的是( )
| A. | 使用可降解塑料聚二氧化碳,能减少白色污染 | |
| B. | 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| C. | 雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| D. | 通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 |
11.分类是化学学习和研学的常用手段.下列分类依据和结论正确的是( )
| A. | 纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物 | |
| B. | HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 经分析某物质只含有一种元素,则该物质一定是纯净物 | |
| D. | 金属氧化物一定是碱性氧化物 |
8.用下列装置图进行相应的实验,其中正确的是( )
| A. | 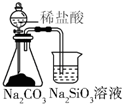 用此图可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 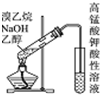 用此图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| C. |  根据此图装置中U型管液面现象,证明装置漏气 | |
| D. | 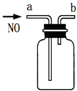 用此图装置收集一瓶纯净的NO |
5.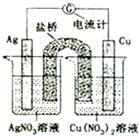 如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
 如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )| A. | 电子从铜电极经导线和盐桥流向银电极 | |
| B. | 电池工作时,K+向铜极的烧杯移动 | |
| C. | 工作一段时间后,右烧杯中溶液的pH变小 | |
| D. | 将AgNO3溶液更换为Fe(NO3)2溶液,电流计指针反向偏转 |
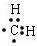 ;
;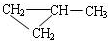 ;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
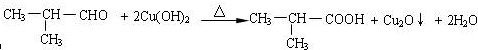 ;
; .
.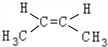 、
、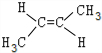 .
.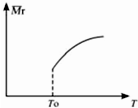 在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g
在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g