14.关于反应:
①2C2H2(g)+5O2(g)=4CO2 (g)+2H2O(l)△H=-2600kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
③CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216kJ•mol-1下列叙述正确的是( )
①2C2H2(g)+5O2(g)=4CO2 (g)+2H2O(l)△H=-2600kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
③CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216kJ•mol-1下列叙述正确的是( )
| A. | 2C2H2(g)+3O2(g)=4CO (g)+2H2O(l)△H=+1468 kJ•mol-1 | |
| B. | 在③反应时,若加入催化剂,可以使△H减小 | |
| C. | 若有3.2g CH4与足量水蒸汽按③反应,则放出热量是43.2 kJ | |
| D. | 若生成相同质量的CO2,则放出的热量C2H2大于CO |
13.对羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.下列有关说法正确的是( )


| A. | 对羟基扁桃酸可以发生消去反应、取代反应和缩聚反应 | |
| B. | 苯酚和对羟基扁桃酸是同系物 | |
| C. | 乙醛酸与H2在热的镍催化下反应生成乙二醇 | |
| D. | 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰 |
12.已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如图:甲$\stackrel{试剂A}{→}$乙$\stackrel{试剂A}{→}$丙,下列说法不正确的( )
| A. | 若乙为NaHCO3,则丙一定是CO2 | |
| B. | 若A为硝酸,X为金属元素,则甲与丙反应可生成乙 | |
| C. | 若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 | |
| D. | 若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 |
9.利用如图实验装置进行实验,能得出相应实验结论的是( )
| ① | ② | ③ | 实验结论 |  | |
| A | 硫酸 | 碳酸钠 | 硅酸钠溶液 | 非金属性:S>C>Si | |
| B | 硝酸 | 碳酸钠 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 盐酸 | 二氧化锰 | 溴化钾溶液 | 氧化性:二氧化锰>氯气>液溴 | |
| D | 溴的苯溶液 | 铁屑 | 硝酸银溶液 | 苯和溴单质在铁的催化剂作用下发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
8.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T的一种氧化物能使品红溶渡褪色.则下列判断不正确的是( )
| R | X | |
| T | ||
| Z | Q |
| A. | R的单质结构式为: | |
| B. | 工业上以海水为原料,经氧化还原反应制备Q的单质 | |
| C. | 非金属性:Z<T<X | |
| D. | R原子与Z原子的电子数相差26 |
7.化学与生活密切相关,下列有关说法正确的是( )
| A. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 | |
| B. | 工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的 | |
| C. | 由于铝的导电性比铜、银都强,所以常用来制造电线、电缆 | |
| D. | NH3能氧化氮氧化物,可用于汽车尾气净化 |
6.烷烃失去一个氢原子剩余的部分叫烷基;烷基也可能有多种结构.如甲基(-CH3)只有一种结构、乙基(-C2H5)只有一种结构、丙基(-C3H7)有两种结构…则己基(-C6H13)的结构有 ( )
| A. | 十五种 | B. | 十六种 | C. | 十七种 | D. | 十八种 |
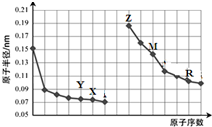
5.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )
0 168568 168576 168582 168586 168592 168594 168598 168604 168606 168612 168618 168622 168624 168628 168634 168636 168642 168646 168648 168652 168654 168658 168660 168662 168663 168664 168666 168667 168668 168670 168672 168676 168678 168682 168684 168688 168694 168696 168702 168706 168708 168712 168718 168724 168726 168732 168736 168738 168744 168748 168754 168762 203614

| A. | 简单离子的半径大小比较:Y>X>Z | |
| B. | 气态氢化物稳定性:X>R | |
| C. | R最高价氧化物对应水化物中既有离子键又有共价键 | |
| D. | Z单质能从M的盐溶液中置换出单质M |
 氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等. 铜及其化台物在工业、农业、科技和日常生活中有广泛应用.
铜及其化台物在工业、农业、科技和日常生活中有广泛应用.