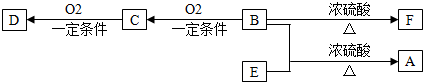
题目内容
8.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T的一种氧化物能使品红溶渡褪色.则下列判断不正确的是( )| R | X | |
| T | ||
| Z | Q |
| A. | R的单质结构式为: | |
| B. | 工业上以海水为原料,经氧化还原反应制备Q的单质 | |
| C. | 非金属性:Z<T<X | |
| D. | R原子与Z原子的电子数相差26 |
分析 T的一种氧化物能使品红溶液褪色,则T为S元素,由元素在周期表中的位置可知,R为N、X为F、Z为As、Q为Br.
A.氮气分子中N原子之间形成3对共用电子对,结构式中用短线“-”代替共用电子对,并省略未成键电子;
B.海水中溴元素主要以溴化物形式存在,经氧化还原反应制备溴单质;
C.同周期自左而右非金属性增强、同主族自上而下非金属性减弱;
D.R原子与Z原子的电子数相差为第三周期、第四周期容纳元素种数.
解答 解:T的一种氧化物能使品红溶液褪色,则T为S元素,由元素在周期表中的位置可知,R为N、X为F、Z为As、Q为Br.
A.氮气分子中N原子之间形成3对共用电子对,其结构式为N≡N,故A错误;
B.工业上以海水为原料,加入氧化剂将溴离子氧化为溴单质,故B正确;
C.同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性:Z<T<X,故C正确;
D.R原子与Z原子的电子数相差为第三周期、第四周期容纳元素种数,即二者原子序数相差8+18=26,故D正确,
故选A.
点评 本题考查元素周期表与元素周期律,难度不大,推断元素是解题关键,熟练掌握元素周期表的结构,注意理解同主族元素原子序数关系.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
20.生活中的一些问题常涉及到化学知识,下列叙述不正确的是( )
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是化合物,钙、铁则分别是Ca2+和Fe3+ | |
| C. | 发生地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情 | |
| D. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁等还原性物质 |
17.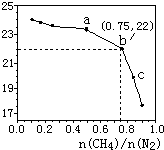 已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )
已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )
 已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )
已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )| A. | n(CH4)/n(N2)越大,CH4的转化率越高 | |
| B. | a点对应的平衡常数比c点的大 | |
| C. | b点对应的NH3的体积分数为26% | |
| D. | 不改变投料比,增加n(N2)时,NH3体积分数增大 |
13.对羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.下列有关说法正确的是( )


| A. | 对羟基扁桃酸可以发生消去反应、取代反应和缩聚反应 | |
| B. | 苯酚和对羟基扁桃酸是同系物 | |
| C. | 乙醛酸与H2在热的镍催化下反应生成乙二醇 | |
| D. | 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰 |
20.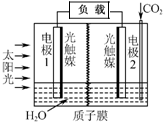 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:
太阳能光触媒2CO2+2H2O $→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:太阳能光触媒2CO2+2H2O $→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
| A. | 电极1周围pH增大 | |
| B. | 电子由电极1经过负载流向电极2 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |
17. X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )
X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )
 X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )
X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )| A. | 简单离子的半径:X3+>Z3- | |
| B. | 元素Z的最外层电子可能为6 | |
| C. | 元素Y的最高价氧化物的水化物可能是强酸 | |
| D. | 元素W的最高价氧化物的水化物属于共价化合物 |
18.传感器可以检测空气中SO2的含量,传感器工作原理如图所示.下列叙述中正确的是( )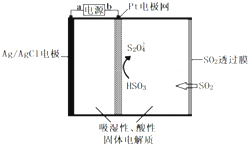

| A. | b为电源的正极 | |
| B. | 负极反应式 Ag-e-+Cl-═AgCl | |
| C. | 当电路中电子转移为5×10-5 mol时,进入传感器的SO2为 1.12 mL | |
| D. | 阴极的电极反应式是:2HSO3-+2H++2e-═S2O42-+2H2O |