题目内容
10. 铜及其化台物在工业、农业、科技和日常生活中有广泛应用.
铜及其化台物在工业、农业、科技和日常生活中有广泛应用.(1)工业上利用辉铜矿(主要成分为Cu2S )冶炼铜.为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,写出该反应的离子方程式Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制各铜盐.现有100mLHNO3 和H2SO4 的混合溶液中,两种酸的物质的量浓度之和为0.6mol.L-1.向该废酸溶液中,加入足量的废铜屑,加热,充分反应后,所得溶液中 Cu2+的物质的量浓度最大值为(反应前后溶液的体积变化忽略不计)0.36mol/L.
(3)现有一块质量为m的生锈铜片,在空气中灼烧至完全反应,经测定,反应后质量仍为m.
①固态铜与适量氧气反应,能量变化如图所示,写出固态铜与氧气反应生成l mol固态氧化铜的热化学方程式Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-$\frac{(a+b)}{4}$kJ•mol-1
②上述铜片中铜的生锈率为34%(金属生锈率=$\frac{已生锈的金属质量}{金属的总质量}$×100%)
(4)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向深部渗透,遇到深层的闪锌矿( ZnS)和方铅矿(PbS),慢慢地转变为铜蓝( CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜等,该过程的化学方程式为CuS+2O2$\frac{\underline{\;一定条件\;}}{\;}$CuSO4 .
②写出渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq),请用简短的语言解释该反应发生的原理在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生).
分析 (1)辉铜矿(主要成分是Cu2S)冶炼铜,和酸性高锰酸钾溶液反应生成铜离子,硫酸根离子,高锰酸根离子被还原为锰离子,结合原子守恒和电荷守恒配平书写;
(2)发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,n(H+):n(NO3-)=4:1,溶解的Cu最多,结合反应计算;
(3)①由图象生成4 mol固态氧化铜放出(a+b)kJ的热量可知,以此书写反应过程中的热化学方程式;
②由化学方程式灼烧后质量不变,反应的氧气和生成的二氧化碳和水的质量相同,结合金属生锈率=$\frac{已生锈的金属质量}{金属的总质量}$×100%计算;
(4)①硫化铜与氧气在淋滤作用下生成硫酸铜;
②硫化铜溶解度小于硫化锌,硫酸铜溶液遇到闪锌矿发生沉淀转化反应生成硫化铜.
解答 解:(1)辉铜矿(主要成分是Cu2S)冶炼铜,和酸性高锰酸钾溶液反应生成铜离子,硫酸根离子,高锰酸根离子被还原为锰离子,反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O,故答案为:Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O;
(2)设含有c(HNO3)=xmol•L-1,c(H2SO4)=ymol•L-1的废酸混合液100mL,由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,n(H+):n(NO3-)=4:1,溶解的Cu最多,则$\left\{\begin{array}{l}{x+y=0.6}\\{\frac{x+2y}{x}4}\end{array}\right.$,解得x=0.24mol/L,则溶解的Cu为$\frac{0.24mol/L×0.1L×3}{2}$=0.036mol/L,所以所得溶液中Cu2+的物质的量浓度最大值为$\frac{0.036mol/L}{0.1L}$=0.36mol/L,
故答案为:0.36mol/L;
(3)①由图象可知:①4Cu(s)+O2(g)=2Cu2O(s)△H=-akJ/mol,②2Cu2O(s)+O2(g)=4CuO(s)△H=-bKJ/mol;
由盖斯定律计算(①+2)×$\frac{1}{4}$得到Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-$\frac{(a+b)}{4}$kJ•mol-1;
故答案为:Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-$\frac{(a+b)}{4}$kJ•mol-1;
②含有铜绿的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同,说明反应的氧气质量和生成的二氧化碳、水蒸气的质量相同计算得到,设铜绿中铜物质的量为x,铜绿物质的量为y,
2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,
x 0.5x
Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2+H2O
y y y
0.5x×32=18y+44y
x:y=31:8,
由元素守恒可知,金属生锈率=$\frac{已生锈的金属质量}{金属的总质量}$×100%=$\frac{2y×64}{(2y+x)×64}$×100%=$\frac{2×\frac{8}{31}x×64}{(2×\frac{8}{31}x+x)×64}$×100%=34%,
故答案为:34%;
(4)①硫化铜与氧气在淋滤作用下生成硫酸铜,反应的化学方程式为:CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4 ,故答案为:CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4 ;
②渗透到地下深层的硫酸铜溶液遇到闪锌矿,在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生),硫化铜溶解性小于硫化锌,发生沉淀转化反应,反应的离子方程式:Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq),
故答案为:Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生).
点评 本题考查较综合,涉及离子反应、化学方程式计算、沉淀转化原理等,综合性较强,侧重化学反应原理及分析与应用能力的考查,(2)中计算为解答的难点,题目难度中等.

| A | B | C | D |
| 除去Cl2中的HCl | 制取少量纯净的CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
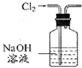 | 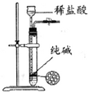 | 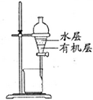 | 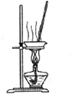 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 加碘食盐中加入的是碘单质,可防止甲状腺肿大疾病 | |
| D. | 要除去衣服上的顽固污渍,均可将衣服泡在漂白液中 |
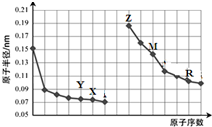
| A. | 简单离子的半径大小比较:Y>X>Z | |
| B. | 气态氢化物稳定性:X>R | |
| C. | R最高价氧化物对应水化物中既有离子键又有共价键 | |
| D. | Z单质能从M的盐溶液中置换出单质M |
 在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )| A. | 4 min内 v(Z)=0.025 mol•L-1•min-1 | |
| B. | Y的平衡转化率为75% | |
| C. | 平衡常数K=(25/12)(mol•L-1)-2 | |
| D. | t1 min时充入少量He,平衡向正向移动 |

| A. | 放电时,OH-向镍电极作定向移动 | |
| B. | 放电时,负极的电极反应为:H2-2e-+2OH-═2H2O | |
| C. | 充电时,将电池的碳电极与外电源的正极相连 | |
| D. | 充电时,阴极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
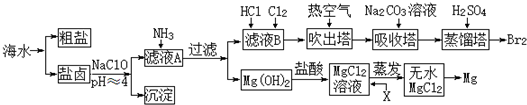

 (R1、R2、R3代表烃基或氢原子)
(R1、R2、R3代表烃基或氢原子) .
. .
. .若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).
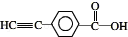
.若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).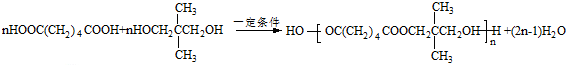 .
.
 .
.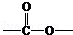 基团
基团 
