题目内容
14.关于反应:①2C2H2(g)+5O2(g)=4CO2 (g)+2H2O(l)△H=-2600kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
③CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216kJ•mol-1下列叙述正确的是( )
| A. | 2C2H2(g)+3O2(g)=4CO (g)+2H2O(l)△H=+1468 kJ•mol-1 | |
| B. | 在③反应时,若加入催化剂,可以使△H减小 | |
| C. | 若有3.2g CH4与足量水蒸汽按③反应,则放出热量是43.2 kJ | |
| D. | 若生成相同质量的CO2,则放出的热量C2H2大于CO |
分析 A.依据热化学方程式和盖斯定律计算,依据盖斯定律计算①-②×2得到的热化学方程式分析;
B.催化剂能改变反应速率,但无法改变反应的△H;
C.化学计量数与反应热成正比,根据热化学方程式分析解答;
D.生成相同质量的CO2,结合C2H2和CO燃烧的热化学方程式的反应热进行比较.
解答 解:A.①2C2H2(g)+5O2(g)=4CO2 (g)+2H2O(l)△H=-2600kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
依据盖斯定律计算①-②×2得到,2C2H2(g)+3O2(g)=4CO (g)+2H2O(l)△H=-1468 kJ•mol-1故A错误;
B.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,在反应体系中加入催化剂,催化剂改变反应速率,不改变化学平衡,反应热不变,故B错误;
C.3.2g CH4的物质的量为n=$\frac{n}{M}$=$\frac{3.2g}{16g/mol}$=0.2mol,CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+216kJ/mol,所以应吸收热量是43.2 kJ,故C错误;
D.假设都生成2molCO2,C2H2燃烧放出1300KJ热量,CO燃烧放出566kJ,前者大于后者,故D正确;
故选D.
点评 本题考查热化学方程式含义及反应热的大小比较,题目难度不大,关键是注意反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.将一定量铁粉和铜粉的混合物加入由稀硫酸和稀硝酸组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是( )
| A. | 反应过程中不可能产生H2 | |
| B. | 剩余的金属粉末中一定有铜 | |
| C. | 往反应后的溶液中加入KSCN 溶液会变血红色 | |
| D. | 往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
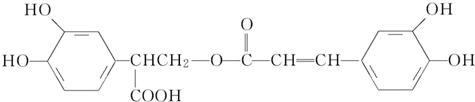
6.迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为
 ,
,
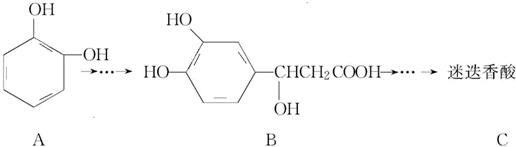
以邻苯二酚为原料合成迷迭香酸的路线为
下列说法正确的是( )
 ,
,以邻苯二酚为原料合成迷迭香酸的路线为

下列说法正确的是( )
| A. | 有机物B可以发生取代、加成、消去、氧化反应 | |
| B. | 有机物A分子中所有原子一定在同一平面上 | |
| C. | 有机物C在浓硫酸催化下水解的一种产物是B | |
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
3.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合物的化学式不可能是( )
| A. | X2YZ3 | B. | X2YZ4 | C. | X3YZ4 | D. | X4Y2Y7 |
9.利用如图实验装置进行实验,能得出相应实验结论的是( )
| ① | ② | ③ | 实验结论 |  | |
| A | 硫酸 | 碳酸钠 | 硅酸钠溶液 | 非金属性:S>C>Si | |
| B | 硝酸 | 碳酸钠 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 盐酸 | 二氧化锰 | 溴化钾溶液 | 氧化性:二氧化锰>氯气>液溴 | |
| D | 溴的苯溶液 | 铁屑 | 硝酸银溶液 | 苯和溴单质在铁的催化剂作用下发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
19.下列说法正确的是( )
| A. | 最简式为C2H4O的有机物一定可以发生银镜反应 | |
| B. | 不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 | |
| C. | 分子结构中含有4个甲基、碳原子数最少的烷烃的系统命名为:2,2-二甲基丙烷 | |
| D. | 甘油和甲苯只有在物质的量之比1:1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同 |
6.Mg,Mg2+两种粒子中不相同的是( )
①核内质子数
②核外电子数
③最外层电子数
④核外电子层数.
①核内质子数
②核外电子数
③最外层电子数
④核外电子层数.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
4.能大量共存于同一溶液中,且当加入另一种强电解质使水电离出的c(H+)=1×10-13mol•L-1时又一定能发生反应的离子组是( )
| A. | Fe2+、Na+、SCN-、Cl- | B. | Ca2+、Cu2+、NO3-、SO32- | ||
| C. | Na+、Ba2+、Cl-、HCO3- | D. | Al3+、Na+、SO42-、NO3- |