10.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
(1)①的元素符号是Li;
(2)②和③两种元素相比较,原子半径较小的是:N(填元素符号)
(3)⑥和⑦的气态氢化物中,最稳定的是HCl(填化学式)
(4)写出④的单质与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | Be | ② | ③ | Ne | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | |||||
(2)②和③两种元素相比较,原子半径较小的是:N(填元素符号)
(3)⑥和⑦的气态氢化物中,最稳定的是HCl(填化学式)
(4)写出④的单质与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
8.化学与社会、生活密切相关.下列事实、现象或解释都正确的是( )
| 选项 | 事实 | 现象或解释 |
| A | 不法分子燃烧硫磺熏制银耳 | 二氧化硫有还原性 |
| B | 可用浓氨水检验输送煤气的管道是否有泄漏 | 出现白烟处是煤气泄漏点 |
| C | 泡沫灭火器使用的物质是硫酸铝和碳酸钠 | 二者混合发生双水解反应生成二氧化碳和氢氧化铝 |
| D | 医院里常用来紫外线灯进行杀菌消毒 | 紫外线能使蛋白质变性 |
| A. | A | B. | B | C. | C | D. | D |
6.下列说法或表示方法正确的是( )
0 168515 168523 168529 168533 168539 168541 168545 168551 168553 168559 168565 168569 168571 168575 168581 168583 168589 168593 168595 168599 168601 168605 168607 168609 168610 168611 168613 168614 168615 168617 168619 168623 168625 168629 168631 168635 168641 168643 168649 168653 168655 168659 168665 168671 168673 168679 168683 168685 168691 168695 168701 168709 203614
| A. | 已知Ka(HCN)<Ka(CH3COOH),当物质的量浓度相同时,CH3COOH中水电离出c(H+)大于HCN中水电离出的c(H+) | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 向2.0 mL浓度均为0.1 mol•L-1 的KCl、KI混合溶液中滴加1~2滴0.01 mol•L-1 AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大 | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
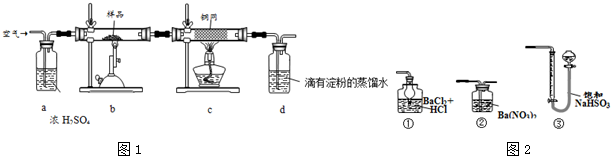
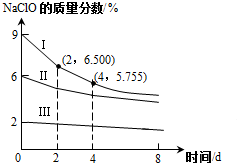 氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.
氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.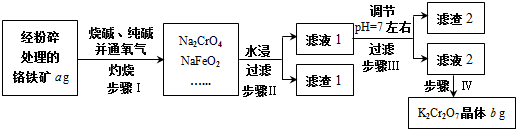
 的合成路线如图所示:
的合成路线如图所示: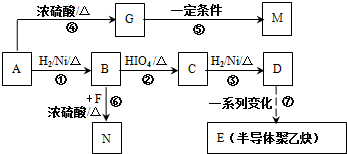
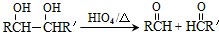
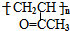 .
. .
.