题目内容
10.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | Be | ② | ③ | Ne | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | |||||
(2)②和③两种元素相比较,原子半径较小的是:N(填元素符号)
(3)⑥和⑦的气态氢化物中,最稳定的是HCl(填化学式)
(4)写出④的单质与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
分析 由元素在周期表的位置可知,①为Li,②为C,③为N,④为Na,⑤为Al,⑥为S,⑦为Cl,
(1)①为Li元素;
(2)②和③同周期,原子序数大的原子半径小;
(3)非金属性越强,气态氢化物越稳定;
(4)Na与水反应生成NaOH和氢气.
解答 解:由元素在周期表的位置可知,①为Li,②为C,③为N,④为Na,⑤为Al,⑥为S,⑦为Cl,
(1)①为Li元素,故答案为:Li;
(2)②和③同周期,原子序数大的原子半径小,则原子半径较小的是N,故答案为:N;
(3)非金属性Cl>S,则气态氢化物最稳定的为HCl,故答案为:HCl;
(4)Na与水反应生成NaOH和氢气,离子反应为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评 本题考查位置结构与性质的关系及元素周期表和元素周期律,为高频考点,把握元素的位置分析元素为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
20.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的氧化铜粉末 | B. | 二氧化碳通过过氧化钠粉末 | ||
| C. | 铝与氧化铁发生铝热反应 | D. | 将锌粒投入硝酸铜溶液中 |
1.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在Cl2与NaOH溶液的反应中,每0.1molCl2参加反应时,转移电子的数目为0.2NA | |
| B. | 0.1mol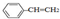 中含有双键的数目为0.4NA 中含有双键的数目为0.4NA | |
| C. | 标准状况下,11.2L乙醇中含有羟基的数目为0.5NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
18.常温,下列各组离子一定能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在透明溶液中:Na+、Cu2+、SO42-、NO3- | |
| C. | 在c(H+)=10-13 mol/L的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
15.下列离子方程式正确的是( )
| A. | 1 mol Cl2通入含有1 mol FeBr2的溶液中:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| B. | 用两根铜棒作电极电解盐酸:2H-+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
2.某有机物的结构简式如图所示.下列关于该有机物的叙述错误的是( )


| A. | 分子式为C12H14O3 | B. | 分子中含有三种含氧官能团 | ||
| C. | 能够发生加成反应和取代反应 | D. | 可使溴水和酸性高锰酸钾溶液褪色 |
19.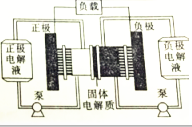 燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
 燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )| A. | 该电池应该在负极通入空气 | |
| B. | 放电时,Li+透过固体电解质向负极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+2e-═2Cu+O2- | |
| D. | 整个反应过程中,铜相当于催化剂,氧化剂实质是O2 |
20.乙苯催化脱氢制苯乙烯反应:
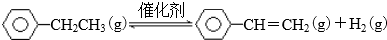
(1)已知:
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
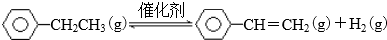
(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
 氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.
氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.