题目内容
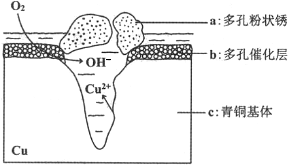
6.下列说法或表示方法正确的是( )| A. | 已知Ka(HCN)<Ka(CH3COOH),当物质的量浓度相同时,CH3COOH中水电离出c(H+)大于HCN中水电离出的c(H+) | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 向2.0 mL浓度均为0.1 mol•L-1 的KCl、KI混合溶液中滴加1~2滴0.01 mol•L-1 AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大 | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
分析 A、Ka(HCN)<Ka(CH3COOH),当物质的量浓度相同时,CH3COOH溶液的酸性强于HCN;
B、根据物质能量高的不稳定;
C、难溶物类型相同的盐,溶度积常数大的物质向溶度积小的物质转化;
D、根据燃烧热的定义判断.
解答 解:A、Ka(HCN)<Ka(CH3COOH),当物质的量浓度相同时,CH3COOH溶液的酸性强于HCN,酸性越强,对水的电离的抑制程度越大,故CH3COOH中水电离出的C(H+)小于HCN中水电离出的c(H+),故A错误;
B、由C(石墨)=C(金刚石);△H=+1.90 kJ/mol可知金刚石的能量比石墨的能量高,所以石墨比金刚石稳定,故B错误.
C、难溶物类型相同的盐,溶度积常数大的物质向溶度积小的物质转化,2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加2滴0.01mol•L-1 AgNO3溶液,沉淀呈黄色,说AgCl的Ksp比AgI的Ksp大,故C正确;
D、氢气的燃烧热是指1mol氢气完全燃烧生产液态水放出的热量,故D错误.
故选C.
点评 本题考查反应热与焓变,综合考查学生对化学反应与能量变化的理解,为高考常见题型,注意相关基础知识的积累,注意把握问题的角度,理解物质的聚集状态与能量的关系、稳定的大小比较等问题.

练习册系列答案
相关题目
1.用糖类物质制备乙酸乙酯的合成路线之一如图所示:
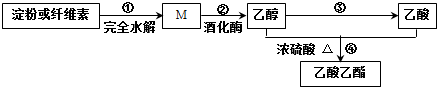
下列说法正确的是( )

下列说法正确的是( )
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 反应②:1 mol M可生成3 mol CH3CH2OH | |
| C. | 反应③:所需反应条件可为酸性重铬酸钾溶液 | |
| D. | 反应④:产物通入滴有酚酞的饱和碳酸钠溶液中振荡、静置后下层溶液颜色无变化 |
18.X、Y、Z、W、T五种元素,其中X、Y、Z、T在周期表中的相对位置如表,X元素的单质是空气中含量最多的成分.W的单质有毒气体,常用于自来水的消毒杀菌,下列说法正确的是( )
| X | Y | |
| Z | ||
| T |
| A. | 原子半径:T>W>Z | |
| B. | 元素T与X的原子序数相差15 | |
| C. | T、Z、W三种元素的最高价氧化物对应的水化物的酸性依次减弱 | |
| D. | X、W两元素的氢化物的浓溶液相互靠近时有白烟产生 |
15.NA为阿伏加德罗常数的值,下列说法一定正确的是( )
| A. | 1 L 1 mol•L-1的醋酸溶液中含有的醋酸分子数为NA | |
| B. | 电解精炼铜时,当阳极上质量减少6.4 g时,电路中转移的电子数为2NA | |
| C. | 常温下,46 g NO2和N2O4的混合物中含有的氧原子数为2NA | |
| D. | 11.2 L CO2中含有的分子数为0.5NA |
 ,D的核磁共振氢谱图中将出现4种峰;
,D的核磁共振氢谱图中将出现4种峰; ;
;
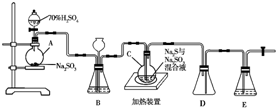 工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:
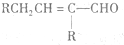 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸
兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸 合成兔耳草醛的路线如下:
合成兔耳草醛的路线如下:
 、
、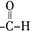 (写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热
(写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热 .
. 、
、 .
.