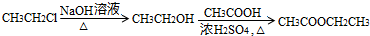题目内容
12.在常压100℃条件下,V L乙烷,乙烯和乙醇的混合气体,完全燃烧后生成CO2和H2O消耗相同状态下氧气3.3VL,则混合气体中乙烷,乙烯和乙醇的体积比可能为3:2.分析 乙烯和乙醇耗氧量为相等,令乙烯、乙醇和乙烷的体积分别为xL、yL,根据反应的方程式:
乙烯、乙醇+3O2
xL 3xL
2C2H6+7O2点燃→4CO2+6H2O,
yL 72y
表示出各自消耗的氧气体积,列方程组计算.
解答 解:乙烯和乙醇耗氧量为相等,令乙烯、乙醇和乙烷的体积分别为xL、yL,根据反应的方程式:
乙烯、乙醇~3O2
xL 3xL
2C2H6+7O2点燃→4CO2+6H2O,
yL 72y
所以{x+y=V72y+3x=3.3V,解之得:xy=23,则V(乙烷):V(乙烯和乙醇)=3:2,而乙烯和乙醇体积任意比,故答案为:3:2.
点评 本题考查有机物耗氧量规律,难度较小,掌握有机物耗氧量规律,注意知识的归纳总结.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目
3.由一种阳离子和两种酸根离子组成的盐称混盐.下列关于混盐Na4S2O3的有关判断,不正确的是( )
| A. | 向溶液中加入酚酞溶液变红,说明该混盐水溶液呈碱性 | |
| B. | 向该混盐中加入稀H2SO4可以产生使品红褪色的气体 | |
| C. | 该混盐在酸性条件下可以产生淡黄色浑浊 | |
| D. | 用玻璃棒蘸取该混盐溶液灼烧,火焰呈黄色,说明溶液中含有Na+ |
20.下列关于反应 4Li+2SOC12═4LiCl+S+SO2↑的叙述中,不正确的是( )
| A. | SOCl2是氧化剂,Li是还原剂 | |
| B. | 2 mol SOCl2参加反应,共转移4 mol电子 | |
| C. | 若将该反应设计成原电池,SOCl2在正极发生反应 | |
| D. | 若将该反应设计成原电池,可用稀硫酸作电解质溶液 |
17.有机物 与氯气发生取代反应,生成的一氯代物有( )
与氯气发生取代反应,生成的一氯代物有( )
 与氯气发生取代反应,生成的一氯代物有( )
与氯气发生取代反应,生成的一氯代物有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
4.一定温度下,可逆反应A(气)+3B(气)?2C(气)在一定容积的密闭容器中进行,达到平衡的标志是( )
| A. | 混合气体的密度不再变化 | B. | A、B、C的浓度相等 | ||
| C. | 混合气体的压强不再变化 |
1.关于烷烃的叙述不正确的是( )
| A. | 分子式符合CnH2n+2的烃一定是烷烃 | |
| B. | 烷烃均能与氯水发生取代反应 | |
| C. | 辛烷的熔沸点比壬烷低 | |
| D. | 烷烃不能被酸性高锰酸钾等强氧化剂氧化 |
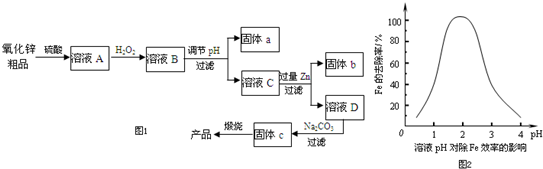

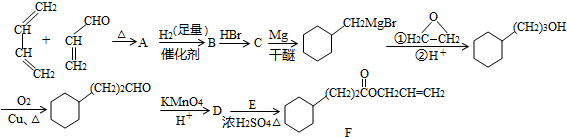
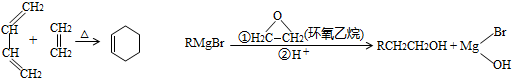
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
.  .
.