题目内容
5. 氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.
氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.(1)已知20mL 0.50mol/L盐酸和20mL 0.55mol/L NaOH溶液中和反应的反应热△H=-a kJ/mol(a>0).若将上述盐酸用20mL 0.25mol/L稀硫酸替代,则此反应的热化学方程式为H2SO4(aq)+2NaOH(aq)=Na2SO4 (aq)+2H2O (l)△H=-200a kJ/mol.
(2)用离子方程式解释家用洁厕灵(含盐酸)不能与漂白液混合使用的原因:Cl-+ClO-+2H+=Cl2↑+H2O.
(3)将一定量饱和氯水加入到盛有大理石粉末的试管中,充分振荡,可观察到粉末逐渐消失,氯水浅黄绿色逐渐褪去,同时产生少量气体,再向上述溶液中滴加几滴石蕊试剂,发现试剂紫色迅速褪去,其原因是大理石消耗了氯水中的H+,而使Cl2+H2O?H++Cl-+HClO的平衡向正向移动,使HClO浓度加大,故漂白速率增大,漂白效果增强.
(4)铁制品直接接触漂白液时会发生电化学腐蚀,其正极的电极反应为:ClO-+2e-+H2O=Cl-+2OH-.
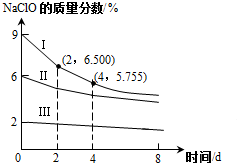
(5)30℃时含NaClO质量分数不同但pH均为11的三种溶液,NaClO的质量分数随时间变化的曲线如图所示:
①由图示得出的结论:相同条件下,NaClO的质量分数越高,分解速率越快.
②忽略溶液体积变化,设漂白液的密度为1g/cm3,计算Ⅰ曲线2d~4d(以2d计)内平均分解速率v(NaClO)=0.05 mol/(L•d).
③工业上用电解冷饱和食盐水的方法可制得NaClO,写出其总反应的离子方程式:Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.
分析 (1)20mL 0.50mol/L盐酸和20mL 0.55mol/L NaOH溶液中和反应,盐酸的物质的量为0.01mol,反应生成0.01mol水,其反应热△H=-a kJ/mol(a>0),则生成2mol水放出的热量为200akJ;
(2)酸性条件下,氯离子与次氯酸根离子反应生成氯气;
(3)氯水中存在Cl2+H2O?H++Cl-+HClO,加碳酸钙消耗氢离子,平衡正移;
(4)Fe与次氯酸根离子形成原电池时,次氯酸根离子在正极上得电子;
(5)①NaClO的质量分数越高,反应所用时间越短;
②设溶液的体积为1L,则在2d时次氯酸钠的质量为1000×6.500%=65.00g,4d时次氯酸钠的质量为1000×5.755%=57.55g,其质量变化为7.45g,再求出物质的量变化及反应速率;
③电解冷饱和食盐水,在阴极上氢离子得电子生成氢气,氯离子在阳极失电子生成次氯酸根离子.
解答 解:(1)20mL 0.50mol/L盐酸和20mL 0.55mol/L NaOH溶液中和反应,盐酸的物质的量为0.01mol,反应生成0.01mol水,其反应热△H=-a kJ/mol(a>0),则生成2mol水放出的热量为200akJ,则稀硫酸与氢氧化钠的热化学方程式为H2SO4(aq)+2NaOH(aq)=Na2SO4 (aq)+2H2O (l)△H=-200a kJ/mol;
故答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4 (aq)+2H2O (l)△H=-200a kJ/mol;
(2)酸性条件下,氯离子与次氯酸根离子反应生成氯气,氯气属于有毒气体,其反应的离子方程为:Cl-+ClO-+2H+=Cl2↑+H2O;
故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;
(3)氯水中存在Cl2+H2O?H++Cl-+HClO,加碳酸钙消耗氢离子,生成二氧化碳,平衡正移,则反应的现象为氯水浅黄绿色逐渐褪去,同时产生少量气体;由于Cl2+H2O?H++Cl-+HClO的平衡正向移动,使HClO浓度加大,故漂白速率增大,漂白效果增强,所以溶液中滴加几滴石蕊试剂,发现试剂紫色迅速褪去;
故答案为:氯水浅黄绿色逐渐褪去,同时产生少量气体;大理石消耗了氯水中的H+,而使Cl2+H2O?H++Cl-+HClO的平衡向正向移动,使HClO浓度加大,故漂白速率增大,漂白效果增强;
(4)Fe与次氯酸根离子形成原电池时,次氯酸根离子在正极上得电子,则正极的电极反应式为:ClO-+2e-+H2O=Cl-+2OH-;
故答案为:ClO-+2e-+H2O=Cl-+2OH-;
(5)①由图可知,NaClO的质量分数越高,反应所用时间越短,反应速率越快;
故答案为:相同条件下,NaClO的质量分数越高,分解速率越快;
②设溶液的体积为1L,溶液的密度为1g/cm3,则在2d时次氯酸钠的质量为1000×6.500%=65.00g,4d时次氯酸钠的质量为1000×5.755%=57.55g,
其质量变化为7.45g,
则△n=$\frac{m}{M}$=$\frac{7.45g}{74.5g/mol}$=0.1mol,v=$\frac{\frac{0.1mol}{1L}}{2d}$=0.05mol/(L•d);
故答案为:0.05;
③电解冷饱和食盐水,在阴极上氢离子得电子生成氢气,氯离子在阳极失电子生成次氯酸根离子,则电解反应的离子方程式:Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑;
故答案为:Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.
点评 本题考查了热化学方程式、有关方程式的计算、原电池原理和电解池原理的应用、反应速率的计算等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)Si位于元素周期表第三周期第ⅣA族,Fe2+的离子结构示意图为
 ,Cl的基态原子外围电子层排布式为3s23p5;
,Cl的基态原子外围电子层排布式为3s23p5;(2)用“>”或“<”填空:
| 第一电离能 | 键能 | 沸点 |
| O>Na | H-Cl>H-Si | CO2<H2O |
(4)黄绿色气体二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.工业上常利用氯酸钠和浓盐酸来制备ClO2,同时还得到一种黄绿色的气体单质、一种无色液体和一种常见离子化合物.写出该反应的化学方程式,并标出电子转移的方向和数目:
 ;
;(5)Ti倍称为继铁铝之后“21世纪”金属,应用前景很广.钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体.在25℃、101KPa下,已知煤消耗7克CO,吸收aKJ热量,该反应的热化学方程式为FeTiO3(s)+CO(g)=TiO2(s)+Fe(s)+CO2(g))△H=+4aKJ•mol-1.
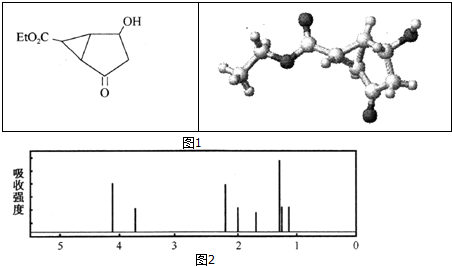
下列关于该有机物的叙述正确的是( )
| A. | 该有机物不同化学环境的氢原子有4种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能够发生取代反应 |
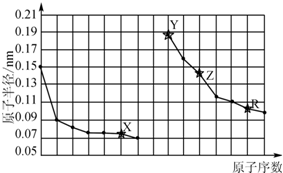
| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:Y>Z>X | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
| A. | SOCl2是氧化剂,Li是还原剂 | |
| B. | 2 mol SOCl2参加反应,共转移4 mol电子 | |
| C. | 若将该反应设计成原电池,SOCl2在正极发生反应 | |
| D. | 若将该反应设计成原电池,可用稀硫酸作电解质溶液 |
| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | Be | ② | ③ | Ne | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | |||||
(2)②和③两种元素相比较,原子半径较小的是:N(填元素符号)
(3)⑥和⑦的气态氢化物中,最稳定的是HCl(填化学式)
(4)写出④的单质与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
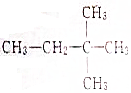 与氯气发生取代反应,生成的一氯代物有( )
与氯气发生取代反应,生成的一氯代物有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
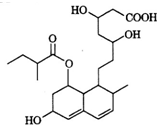 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )| A. | 分子中含有四种官能团 | |
| B. | 1 mol该物质最多可与3 mol NaOH反应 | |
| C. | 能发生加成反应、取代反应、水解反应 | |
| D. | 1 mol该物质最多可与2 mol H2发生加成反应 |
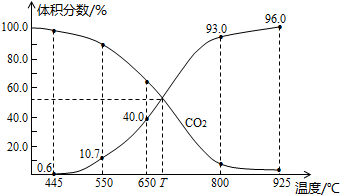
| A. | 550℃时,若充入惰性气体,v正,v退均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总 |