题目内容
9.钠、铝、铁的化合物与人类生活和生产有着密切的联系,请回答下列问题(1)呼吸面具或潜水艇中常用过氧化钠(填“碳酸钠”或“过氧化钠”)作为氧气的来源.
(2)向氢氧化钠溶液中加入铝粉,反应生成的气体是H2.
(3)铁可以形成多种氧化物,其中具有磁性的是C.
A.FeO B.Fe2O3 C.Fe3O4.
分析 (1)过氧化钠能够与空气中的二氧化碳反应生成氧气;
(2)铝和氢氧化钠溶液发生氧化还原反应生成偏铝酸钠和氢气;
(3)根据铁的氧化物是否被磁铁吸引进行解答.
解答 解:(1)过氧化钠能够与空气中的二氧化碳反应生成氧气,常用作为潜水艇呼吸面具中氧气来源,
故答案为:过氧化钠;
(2)铝和氢氧化钠溶液发生氧化还原反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成偏铝酸钠和氢气,
故答案为:H2;
(3)A.氧化亚铁为黑色氧化物,不可被磁铁吸引,故A错误;
B.氧化铁俗称铁红,是一种红棕色的物质,不可被磁铁吸引,故B错误;
C.四氧化三铁为黑色氧化物,但可被磁铁吸引,所以具有磁性,故C正确;
故答案为:C.
点评 本题考查供氧剂、铝与碱溶液的反应、铁的氧化物性质等知识,注意过氧化钠能够与空气中的二氧化碳反应生成氧气,掌握铝与碱溶液的反应原理以及铁的氧化物用途是解题关键,题目难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
19.下列实验过程中,始终无明显现象的是( )
| A. | Cl2通入Na2CO3溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入AgNO3溶液中 | D. | SO2通入NaHS溶液中 |
20.下列有关化学用语的表示不正确的是( )
| A. | NaClO的电子式: | |
| B. | 16O的原子结构示意图: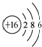 | |
| C. | 质子数为53,中子数为72的碘原子:53125I | |
| D. | 间羟基苯甲醛的结构简式: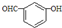 |
17.在水溶液中能大量共存的一组离子是( )
| A. | NH4+、Al3+、NO3-、AlO2- | B. | Na+、Fe3+、HSO3-、OH- | ||
| C. | Cu2+、NH4+、SO42-、Cl- | D. | K+、H+、I-、ClO- |
14.下列有关叙述正确的是( )
| A. | 等体积、等pH的盐酸和醋酸与足量的NaOH溶液反应,消耗NaOH的物质的量相同 | |
| B. | 常温下,某物质的水溶液的pH<7,则该物质一定是酸或强酸弱碱盐 | |
| C. | 常温下,pH=12的氨水与pH=2的盐酸等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
1.化学用语是学习化学的重要工具.以下化学用语或表述正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 碳正离子 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 | |
| C. | 水合氢离子的结构式为 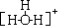 | |
| D. | NaHCO3水解反应的离子方程式:HCO3-+H2O?H3O++CO32- |

 的同分异构体的结构简式:
的同分异构体的结构简式: .
.

 .
. .
.