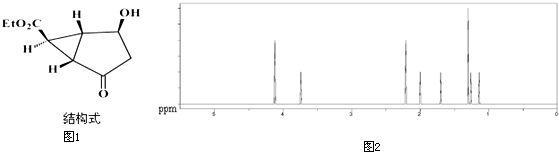
20.下列各项叙述中,正确的是( )
| A. | C6H5CH2CH2OH与C6H5OH互为同系物 | |
| B. | CH3CHO与CH3COOH在一定条件下均能与新制氢氧化铜反应 | |
| C. | 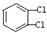 与 与  互为同分异构体 互为同分异构体 | |
| D. | H2O与D2O互为同素异形体 |
19.某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有乙醇(含180)、无水醋酸钠,D中放有含有酚酞饱和碳酸钠溶液.
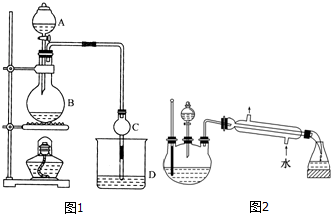
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:CH3COOH+CH3CH218OH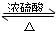 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解.
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,此装置的主要优点有:(请写出两点):①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了冷凝装置,有利于收集产物乙酸乙酯.

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:CH3COOH+CH3CH218OH
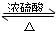 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解.
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,此装置的主要优点有:(请写出两点):①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了冷凝装置,有利于收集产物乙酸乙酯.
18.下列各组物质一定互为同系物的是( )
| A. | CH4与C4H10 | B. | 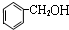 和 和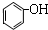 | C. | 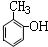 和 和  | D. | C6H12 与C4H10 |
17.下列制备和收集气体的实验装置合理的是( )
| A. | 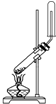 用氯化铵和氢氧化钙制NH3 | B. | 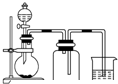 二氧化锰和浓盐酸制氯气 | ||
| C. |  用锌粒和稀硫酸制H2 | D. |  用双氧水和二氧化锰制O2 |
16. 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.该反应△S<0(填“>”、“<”或“=”),在低温(填“高温”“低温”或“任何温度”)下能自发进行.
②已知:分别断裂1mol N2、O2分子中化学键所需要的能量是946kJ、497kJ,则断裂1mol NO分子中化学键所需要的能量为631.25kJ.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v(N2)=1.88×10-4 mol/(L•s).
②在该温度下,反应的平衡常数K=5000 L/mol.(写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明BC (填字母).
A.该反应的反应物混合后很不稳定
B.该反应体系达到平衡时至少有一种反应物的百分含量减小
C.该反应在一定条件下能自发进行
D.该反应使用催化剂意义不大
④研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条件数据.
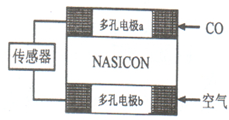
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.
①负极的电极反应式为:CO+O2--2e-═CO2.
②工作时O2-由电极b流向电极a(填a或b)
 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.该反应△S<0(填“>”、“<”或“=”),在低温(填“高温”“低温”或“任何温度”)下能自发进行.
②已知:分别断裂1mol N2、O2分子中化学键所需要的能量是946kJ、497kJ,则断裂1mol NO分子中化学键所需要的能量为631.25kJ.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=1.88×10-4 mol/(L•s).
②在该温度下,反应的平衡常数K=5000 L/mol.(写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明BC (填字母).
A.该反应的反应物混合后很不稳定
B.该反应体系达到平衡时至少有一种反应物的百分含量减小
C.该反应在一定条件下能自发进行
D.该反应使用催化剂意义不大
④研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条件数据.
| 实验编号 | T/℃ | NO初始浓度mol•L-1 | CO初始浓度mol•L-1 | 催化剂的比表面积m2•g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
①负极的电极反应式为:CO+O2--2e-═CO2.
②工作时O2-由电极b流向电极a(填a或b)
15.下列物质属于同系物的一组是( )
| A. | CH4与C2H4 | |
| B. | CH3-CH=CH-CH3 与 CH3-CH2-CH2-CH3 | |
| C. | O2与O3 | |
| D. | C2H6与C3H8 |
14.下列关于有机物的说法中不正确的是( )
| A. | 甲烷与氯气在光照条件下的反应和乙酸与乙醇生成乙酸乙酯的反应均属于取代反应 | |
| B. | 顺-2-丁烯和反-2-丁烯的熔、沸点不相同 | |
| C. | C4H9Br的同分异构体有3种 | |
| D. | 乙烯、苯分子中的所有原子都在同一平面上 |
13.锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”.
Ⅰ.锂的原子结构示意图为 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).
Ⅱ.如图所示是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.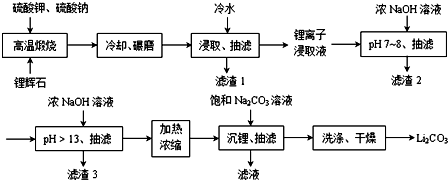
①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
④Li2SO4、Li2CO3在不同温度下的溶解度(g/100g水)
(1)浸取时使用冷水的原因是Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率.
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O、2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
Ⅰ.锂的原子结构示意图为
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物Li2O(填化学式).Ⅱ.如图所示是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.

①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10 | 20 | 50 | 80 |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O、2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+ 浓度和溶液温度,使得Li2CO3容易析出.
(5)洗涤Li2CO3晶体使用热水.
12.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
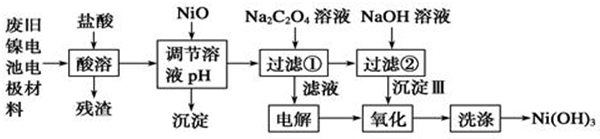
已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)该工艺流程中多次重复利用的一种实验基本操作是过滤.
(2)酸溶所留残渣的主要成分为炭粉(填物质名称)
(3)根据上表数据判断,用NiO调节溶液的pH,依次析出是沉淀Fe(OH)3和沉淀Al(OH)3(填化学式),
控制两种沉淀析出可利用C.
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则加入Na2C2O4溶液发生的化学反应方程式是NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(5)氧化步骤的离子反应方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=2.0×10-5.
0 168477 168485 168491 168495 168501 168503 168507 168513 168515 168521 168527 168531 168533 168537 168543 168545 168551 168555 168557 168561 168563 168567 168569 168571 168572 168573 168575 168576 168577 168579 168581 168585 168587 168591 168593 168597 168603 168605 168611 168615 168617 168621 168627 168633 168635 168641 168645 168647 168653 168657 168663 168671 203614

已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如表所示:
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
(1)该工艺流程中多次重复利用的一种实验基本操作是过滤.
(2)酸溶所留残渣的主要成分为炭粉(填物质名称)
(3)根据上表数据判断,用NiO调节溶液的pH,依次析出是沉淀Fe(OH)3和沉淀Al(OH)3(填化学式),
控制两种沉淀析出可利用C.
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则加入Na2C2O4溶液发生的化学反应方程式是NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(5)氧化步骤的离子反应方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=2.0×10-5.