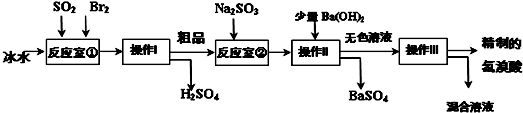
题目内容
16. 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.该反应△S<0(填“>”、“<”或“=”),在低温(填“高温”“低温”或“任何温度”)下能自发进行.
②已知:分别断裂1mol N2、O2分子中化学键所需要的能量是946kJ、497kJ,则断裂1mol NO分子中化学键所需要的能量为631.25kJ.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=1.88×10-4 mol/(L•s).
②在该温度下,反应的平衡常数K=5000 L/mol.(写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明BC (填字母).
A.该反应的反应物混合后很不稳定
B.该反应体系达到平衡时至少有一种反应物的百分含量减小
C.该反应在一定条件下能自发进行
D.该反应使用催化剂意义不大
④研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条件数据.
| 实验编号 | T/℃ | NO初始浓度mol•L-1 | CO初始浓度mol•L-1 | 催化剂的比表面积m2•g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
①负极的电极反应式为:CO+O2--2e-═CO2.
②工作时O2-由电极b流向电极a(填a或b)
分析 (1)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1①
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1②
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1③,
根据盖斯定律,方程式③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g),据此计算;根据气体的物质的量变化判断熵变;根据△H-T△S<0反应自发进行判断;
②已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1,断裂1mol N2、O2分子中化学键所需要的能量是946kJ、497kJ,根据△H=反应物的总键能-生成物的总键能计算;
(2)①根据前2s内NO的浓度变化,求出氮气的浓度变化,再根据V=$\frac{△c}{△t}$来计算解答;
②分析图表数据,依据化学平衡三段式列式计算平衡浓度,再带入化学平衡常数的表达式K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$计算;
③根据化学反应的速率和方向知识进行回答;
④根据实验目的验证温度、催化剂比表面积对化学反应速率的影响规律,则应保证浓度相同,然后相同温度时比较催化剂比表面积,相同催化剂比表面积时比较温度;
(3)①CO在负极失电子生成二氧化碳;
②该原电池中b为正极,a为负极,阴离子从负极流向正极.
解答 解:(1)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1①
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1②
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1③,
根据盖斯定律,方程式③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g),△H=(-393.5kJ•mol-1)×2-(180.5kJ•mol-1)-(-221.0kJ•mol-1)=-746.5 kJ•mol-1;该反应正方向为物质的量减少的方向,则正方向的熵变小于零,即△S<0;该反应的焓变小于零,熵变小于零,若要使△H-T△S<0,则温度的数值必须较小,即该反应在低温下自发进行;
故答案为:-746.5 kJ•mol-1;<;低温;
②已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1,断裂1mol N2、O2分子中化学键所需要的能量是946kJ、497kJ,
设NO的键能为QkJ,△H=反应物的总键能-生成物的总键能=946+497-2Q=+180.5,则Q=631.25;
故答案为:631.25;
(2)①由表格中的数据可知2s内NO浓度的变化量为1.00×10-3-2.50×10-4=7.50×10-4,则氮气的浓度变化为$\frac{1}{2}$×7.50×10-4mol/L,
则υ(N2)=$\frac{\frac{1}{2}×7.50×1{0}^{-4}}{2}$≈1.88×10-4mol•L-1•s-1;
故答案为:1.88×10-4mol•L-1•s-1;
②分析图表数据,依据化学平衡三段式列式计算平衡浓度:
2NO+2CO?2CO2 +N2
起始量(mol/L) 1×10-3 3.6×10-3 0 0
变化量(mol/L) 9×10-4 9×10-4 9×10-4 4.5×10-4
平衡量(mol/L) 1×10-4 2.7×10-3 9×10-4 4.5×10-4
该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{(9×1{0}^{-4})^{2}×4.5×1{0}^{-4}}{(1×1{0}^{-4})^{2}×(2.7×1{0}^{-3})^{2}}$=5000;
故答案为:5000;
③A.该反应的反应物混合能稳定存,在一定条件下,如加入催化剂才能发生反应,故A错误;
B.该反应进行的程度大,反应体系达到平衡时至少有一种反应物的百分含量较小,故B正确;
C.该反应在一定条件下能够自发进行,而且在较短的时间内即可达到平衡状态,故C正确;
D.该反应使用催化剂能加快反应速率,故D错误;
故答案为:BC;
④因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有浓度应控制相同来验证催化剂比表面积对速率的影响;
Ⅱ、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响;
故答案为:
| 实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的 比表面积(m2/g) |
| Ⅰ | ||||
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | |
| Ⅲ | 1.20×10-3 | 5.80×10-3 |
(3)①CO在负极失电子生成二氧化碳,则负极的电极反应式为:CO+O2--2e-═CO2,故答案为:CO+O2--2e-=CO2;
②该燃料电池的正极反应为:O2+4e-=2O2-,则b为正极,a为负极,阴离子从负极流向正极,即O2-由b极向a极迁移,故答案为:b,a.
点评 本题考查了热化学方程式和盖斯定律的计算应用、化学反应速率、化学平衡常数的计算应用、原电池原理的分析应用等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力及计算能力,掌握基础是关键,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 | |
| B. | 凡是在加热或点燃条件下进行的反应都是吸热反应 | |
| C. | 把化学反应中物质的变化和反应的焓变同时表示出的化学方程式叫做热化学方程式 | |
| D. | 氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ |
| A. | 石英与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 向氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO32-+H2O | |
| C. | 向硅酸钠溶液中加入盐酸:2H++SiO32-═H2SiO3↓ | |
| D. | 向碳酸钙上滴稀硝酸:CO32-+2H+═H2O+CO2↑ |
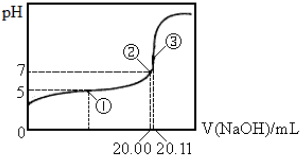
| A. | 该温度下CH3COOH的电离平衡常数约为1.8×10-5 | |
| B. | 点①处溶液中c(CH3COO-)<c(CH3COOH) | |
| C. | 点③处溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(OH-)>c(Na+)>c(H+) |
| A. | 达到平衡时X浓度为0.04 mol•L-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015 mol•L-1 | |
| C. | 若升高温度,X的体积分数增大,则该反应的?△H<0 | |
| D. | 若增大压强,平衡向正反应方向移动,平衡常数变大 |
①2Na2SO3 +O2═2Na2SO4(时间不长);
②2H2SO3+O2═2H2SO4(时间较长);
③2SO2 +O2 $\frac{\underline{\;催化剂\;}}{△}$2SO3.
由此说明还原性由弱到强的顺序是( )
| A. | Na2SO3、H2SO3、SO3、SO2 | B. | SO2 、H2SO3、Na2SO3 | ||
| C. | H2SO4、SO2 、Na2SO3 | D. | Na2SO3、SO2 、H2SO3 |