题目内容
17.下列制备和收集气体的实验装置合理的是( )| A. |  用氯化铵和氢氧化钙制NH3 | B. |  二氧化锰和浓盐酸制氯气 | ||
| C. |  用锌粒和稀硫酸制H2 | D. |  用双氧水和二氧化锰制O2 |
分析 A.反应在加热条件下进行,应防止试管炸裂;
B.二氧化锰和浓盐酸常温下不反应;
C.氢气的密度比空气小;
D.双氧水在二氧化锰催化作用下可生成氧气,氧气可用排水法收集.
解答 解:A.氯化铵和氢氧化钙反应制取氨气,生成物中有水,如果试管口高于试管底,会发生水倒流现象而炸裂试管,且试管口应塞一团棉花,防止氨气与空气对流,故A错误;
B.二氧化锰和浓盐酸在加热条件下反应制备氯气,常温下不反应,且氯气密度比空气大,用向上排空法收集,故B错误;
C.锌粒和盐酸反应制取氢气,属于固体、液体不加热型,生成的氢气的密度小于空气的密度,所以不可用向上排空气法收,故C错误;
D.用过氧化氢与二氧化锰制O2,属于固体、液体不加热型,生成的氧气不易溶于水,所以可采用排水集气法收集,故D正确;
故选D.
点评 本题考查综合考查常见气体制备原理及装置选择,为高频考点,根据反应物的状态及反应条件,可把实验室制备气体发生装置分为:固体、固体加热型,如加热高锰酸钾制取氧气;固体、液体加热型,如制取氯气;固体、液体不加热型,如用稀硫酸和锌粒制取氢气,答题时注意把握物质的性质以及实验的严密性、可行性的评价,难度不大.

练习册系列答案
相关题目
7.下面有关电化学的图示,完全正确的是( )
| A. | 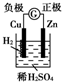 Cu-Zn原电池 | B. | 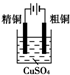 粗铜的精炼 | ||
| C. | 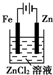 铁片镀锌 | D. | 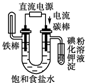 验证NnCl溶液(含酚酞) |
8.下列关于浓硝酸和浓硫酸的叙述正确的是( )
| A. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| B. | 浓硝酸具有不稳定性,实验室里应保存在棕色瓶中 | |
| C. | 常温下,浓硝酸可以跟铜缓慢反应,浓硫酸可与铜片迅速反应 | |
| D. | 实验室可以用浓硝酸来制氢气 |
12.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
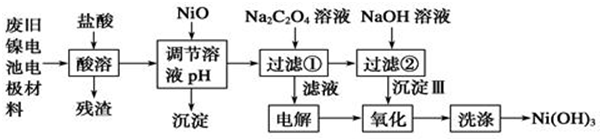
已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)该工艺流程中多次重复利用的一种实验基本操作是过滤.
(2)酸溶所留残渣的主要成分为炭粉(填物质名称)
(3)根据上表数据判断,用NiO调节溶液的pH,依次析出是沉淀Fe(OH)3和沉淀Al(OH)3(填化学式),
控制两种沉淀析出可利用C.
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则加入Na2C2O4溶液发生的化学反应方程式是NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(5)氧化步骤的离子反应方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=2.0×10-5.

已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如表所示:
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
(1)该工艺流程中多次重复利用的一种实验基本操作是过滤.
(2)酸溶所留残渣的主要成分为炭粉(填物质名称)
(3)根据上表数据判断,用NiO调节溶液的pH,依次析出是沉淀Fe(OH)3和沉淀Al(OH)3(填化学式),
控制两种沉淀析出可利用C.
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则加入Na2C2O4溶液发生的化学反应方程式是NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(5)氧化步骤的离子反应方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=2.0×10-5.
2.某课外兴趣小组对H2O2的分解速率做了如下实验探究:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用l0mL H2O2制取150mL O2所需的时问(s)
①验证影响反应速率的因素时要考试控制变量.取相同浓度的H2O2进行实验,上表反应条件中考虑控制单因子变量的是温度、浓度、催化剂.
②对照反应条件a和b,可以说明催化剂 因素对过氧化氢分解的速率有影响,该影响可具体表述为催化剂加快分解速率.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测试结果加下.
①写出加入MnO2后H2O2发生反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②上述实验中,使用粉末状催化剂和块状催化剂所得过氧化氢分解反应的反应速率之比为10:1.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用l0mL H2O2制取150mL O2所需的时问(s)
| 浓度 时间(s) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热(t1℃) | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热(t2℃) | 360(a) | 480 | 540 | 720 |
| MnO2催化剂、加热(t2℃) | 10(b) | 25 | 60 | 120 |
②对照反应条件a和b,可以说明催化剂 因素对过氧化氢分解的速率有影响,该影响可具体表述为催化剂加快分解速率.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测试结果加下.
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②上述实验中,使用粉末状催化剂和块状催化剂所得过氧化氢分解反应的反应速率之比为10:1.
9.氢能是未来能源结构中最具发展潜力的清洁能源之一.目前已有专家已研究出用淀粉或纤维素与水在酶作用下转变为二氧化碳和氢气的方法制氢气.下列说法错误的是( )
| A. | 从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| B. | 上述制氢气的化学方程式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$ 6nCO2↑+12nH2↑ | |
| C. | 氢元素的三种同素异形体${\;}_{1}^{1}H$、${\;}_{1}^{2}H$、${\;}_{1}^{3}H$,能形成六种单质 | |
| D. | 从化学的本质看该反应属于氧化还原反应 |
6.某油脂样品跟氢氧化钠溶液共热后经酸化得到3种有机物,原样品最多可能含有的三羧酸甘油酯有( )
| A. | 3种 | B. | 6种 | C. | 7种 | D. | 8种 |
