题目内容
12.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程: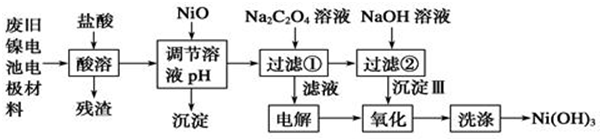
已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如表所示:
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
(1)该工艺流程中多次重复利用的一种实验基本操作是过滤.
(2)酸溶所留残渣的主要成分为炭粉(填物质名称)
(3)根据上表数据判断,用NiO调节溶液的pH,依次析出是沉淀Fe(OH)3和沉淀Al(OH)3(填化学式),
控制两种沉淀析出可利用C.
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则加入Na2C2O4溶液发生的化学反应方程式是NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(5)氧化步骤的离子反应方程式2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=2.0×10-5.
分析 废旧镍电池电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成的,加入盐酸,其中碳粉不反应,过滤得到残渣为炭粉,结合信息①可知,滤液中含有NiCl2、AlCl3、FeCl3及未反应的HCl,加入NiO调节溶液pH,使溶液中Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,过滤除去,滤液中加入Na2C2O4溶液,由(4)中NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,所以生成的沉淀为NiC2O4•2H2O,沉淀中加入NaOH溶液,由溶度积可知转化为Ni(OH)2.过滤分离得到Ni(OH)2.过滤①的滤液主要是氯化钠溶液,电解氯化钠溶液得到氢氧化钠、氯气与氢气,沉淀Ⅲ可被电解所得产物之一氧化,氧化产物洗涤得到Ni(OH)3,应是Ni(OH)2被氯气氧化.
(6)若Fe(OH)3和Al(OH)3同时存在,由溶度积表达式可知$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=$\frac{Ksp[Fe(O{H)}_{3}]}{Ksp[Al(OH)_{3}]}$.
解答 解:废旧镍电池电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成的,加入盐酸,其中碳粉不反应,过滤得到残渣为炭粉,结合信息①可知,滤液中含有NiCl2、AlCl3、FeCl3及未反应的HCl,加入NiO调节溶液pH,使溶液中Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,过滤除去,滤液中加入Na2C2O4溶液,由(4)中NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,所以生成的沉淀为NiC2O4•2H2O,沉淀中加入NaOH溶液,由溶度积可知转化为Ni(OH)2,过滤分离得到Ni(OH)2.过滤①的滤液主要是氯化钠溶液,电解氯化钠溶液得到氢氧化钠、氯气与氢气,沉淀Ⅲ可被电解所得产物之一氧化,氧化产物洗涤得到Ni(OH)3,应是Ni(OH)2被氯气氧化.
(1)由上述分析可知,该工艺流程中多次重复利用的一种实验基本操作是:过滤,
故答案为:过滤;
(2)加入盐酸,其中碳粉不反应,过滤得到残渣为炭粉,
故答案为:炭粉;
(3)根据表中开始沉淀和沉淀完全pH,Fe(OH)3开始沉淀pH=2.53\沉淀完全pH=2.94,Al(OH)3开始沉淀pH=3.43、沉淀完全pH=4.19,用NiO调节溶液的pH,依次沉淀为:Fe(OH)3,Al(OH)3,由于小于连续测定pH,且精度较高,应选择pH计控制两种沉淀析出的pH,
故答案为:Fe(OH)3;Al(OH)3 ;C;
(4)NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,所以生成的沉淀为NiC2O4•2H2O,反应的化学方程式为:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl;
故答案为:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl;
(5)沉淀Ⅲ为Ni(OH)2,被氯气氧化得到Ni(OH)3,该氧化反应的离子方程式为:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-;
故答案为:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-;
(6)若Fe(OH)3和Al(OH)3同时存在,由溶度积表达式可知$\frac{c(F{e}^{3+})}{c(A{l}^{3+})}$=$\frac{Ksp[Fe(O{H)}_{3}]}{Ksp[Al(OH)_{3}]}$=2.0×10-5,故答案为:2.0×10-5.
点评 本题考查化学工艺流程、物质的分离提纯、沉淀转化、电化学原理等,关键是对工艺流程的理解,是对学生综合能力的考查,需要学生具备扎实的基础与迁移运用能力,难度中等.

| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 9:2 |
| A. | 相同温度下,在水中,碳酸氢钠的溶解度大于碳酸钠的溶解度 | |
| B. | 将石灰水加入碳酸氢钠溶液中不产生沉淀,加入碳酸钠溶液中产生白色沉淀 | |
| C. | 将100mL0.10mol/L盐酸溶液分别逐滴滴入到10mL1.00 mol/L的碳酸钠溶液或10mL1.00 mol/L碳酸氢钠溶液中,两者都能放出二氧化碳气体,但碳酸氢钠与酸反应产生二氧化碳的剧烈程度明显强于碳酸钠 | |
| D. | 在一定温度下,物质的量浓度相同时,碳酸氢钠溶液的碱性弱于碳酸钠溶液 |
| A. | 铝镁合金的硬度较大,钠钾合金的硬度较小 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜中的铜,钠也能置换硫酸铜中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,无过氧化物 |
| A. | 热的纯碱溶液去油污效果好 | |
| B. | 将TiCl4溶于大量水,同时加热,可得TiO2 | |
| C. | 用Na2CO3溶液和盐酸处理水垢中的CaSO4 | |
| D. | FeCl3溶液加热后颜色变深 |
| A. |  用氯化铵和氢氧化钙制NH3 | B. |  二氧化锰和浓盐酸制氯气 | ||
| C. |  用锌粒和稀硫酸制H2 | D. |  用双氧水和二氧化锰制O2 |
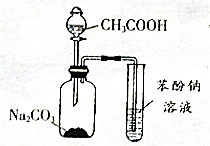 下列关于如图实验的说法错误的是( )
下列关于如图实验的说法错误的是( )| A. | 集气瓶中的离子方程式是:2CH3COOH+CO32-→2CH3COO-+H2O+CO2 ↑ | |
| B. | 少量的CO2通入苯酚钠中生成苯酚和碳酸钠 | |
| C. | 醋酸和苯酚钠发生反应 | |
| D. | 该装置和相关实验现象能推出酸性强弱顺序为:CH3COOH>H2CO3 >C6H5OH |
 ,它在元素周期表中的位置是第4周期ⅡA族,它的最高价氧化物对应水化物的化学式是Ca(OH)2.
,它在元素周期表中的位置是第4周期ⅡA族,它的最高价氧化物对应水化物的化学式是Ca(OH)2.