9.下列有关叙述正确的是( )
| A. | H、D、T具有相同的质子数,是氢元素的三种同位素 | |
| B. | OH-与H3O+组成元素相同,所含质子数相同 | |
| C. | 结构示意图为 和 和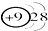 两种粒子为同一种元素 两种粒子为同一种元素 | |
| D. | 元素原子最外层电子数的多少是判断金属性和非金属性强弱的依据 |
7.一定条件下,发生可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)下列叙述中,不能做为此可逆反应已经达到化学平衡状态的标志是( )
| A. | NH3的消耗速率等于NO的生成速率 | |
| B. | NH3的消耗速率等于NO的消耗速率 | |
| C. | NH3的浓度和NO的浓度都不发生改变 | |
| D. | 密闭容器内的压强不发生改变 |
6.下表是元素周期表的一部分,请回答有关问题:
(1)写出元素符号:B:C;E:Ne;F:Na.
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与F最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)最高价氧化物的水化物碱性最强的物质的电子式 .用电子式表示F元素与J元素形成化合物的过程
.用电子式表示F元素与J元素形成化合物的过程
(4)A分别与D、J、K形成的化合物中,最稳定的HF(填化学式).
(5)在B、C、F、G、H中,原子半径最大的是Na(填元素符号).
 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | |||
| 4 | K |
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与F最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)最高价氧化物的水化物碱性最强的物质的电子式
 .用电子式表示F元素与J元素形成化合物的过程
.用电子式表示F元素与J元素形成化合物的过程
(4)A分别与D、J、K形成的化合物中,最稳定的HF(填化学式).
(5)在B、C、F、G、H中,原子半径最大的是Na(填元素符号).
3.已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是( )
| A. | a=b+m-n | B. | a=b-m+n | C. | a-m=b+n | D. | a-m=b-n |
2.下列说法中错误的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 化学反应中的能量变化通常表现为热量的变化 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
1.关于原子结构的叙述不正确的是( )
| A. | 所有的原子核都是由质子和中子组成的 | |
| B. | 原子的最外层电子数不超过8个 | |
| C. | 稀有气体原子的最外层电子数为2或8 | |
| D. | 原子的次外层电子数可能为8 |
20.V2O5 是一种新型光电材料.某课题组模拟生产V2O5工艺部分流程如下:
Ⅰ.配制偏钒酸钠(NaVO3)溶液
(1)向V2O5 固体中缓慢滴加NaOH溶液,边加热边搅拌至V2O5 固体完全溶解,反应的离子方程式为V2O5+2OH-=2VO3-+H2O.
Ⅱ.沉钒
一定条件下向偏钒酸钠溶液中加入氯化铵溶液,加热、搅拌得到偏钒酸铵沉淀.如图为部分因素对沉钒率的影响.
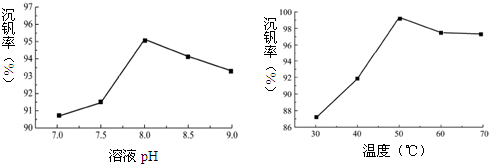
(2)为了提高沉钒率,应调节溶液pH=8.0.已知偏钒酸铵微溶于冷水,可溶于热水,结合图中信息,生成偏钒酸铵沉淀的反应是吸热(填“吸热”或“放热”)反应.
(3)该课题组对影响沉钒率的其他因素(除温度和pH)提出如下假设.
假设一:氯化铵溶液的浓度
假设二:偏钒酸钠溶液浓度
…
(4)结合上述最佳条件设计实验验证假设一,写出实验步骤与结论.
限选试剂:0.5mol/L的偏钒酸钠溶液、1mol/L的氯化铵溶液、蒸馏水,常见实验仪器任选.(提示:沉钒率可用专用仪器测定并计算)
Ⅲ.热分解
(5)偏钒酸铵灼烧产生五氧化二钒,该反应的化学方程式为2NH4VO3$\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5.
0 168332 168340 168346 168350 168356 168358 168362 168368 168370 168376 168382 168386 168388 168392 168398 168400 168406 168410 168412 168416 168418 168422 168424 168426 168427 168428 168430 168431 168432 168434 168436 168440 168442 168446 168448 168452 168458 168460 168466 168470 168472 168476 168482 168488 168490 168496 168500 168502 168508 168512 168518 168526 203614
Ⅰ.配制偏钒酸钠(NaVO3)溶液
(1)向V2O5 固体中缓慢滴加NaOH溶液,边加热边搅拌至V2O5 固体完全溶解,反应的离子方程式为V2O5+2OH-=2VO3-+H2O.
Ⅱ.沉钒
一定条件下向偏钒酸钠溶液中加入氯化铵溶液,加热、搅拌得到偏钒酸铵沉淀.如图为部分因素对沉钒率的影响.

(2)为了提高沉钒率,应调节溶液pH=8.0.已知偏钒酸铵微溶于冷水,可溶于热水,结合图中信息,生成偏钒酸铵沉淀的反应是吸热(填“吸热”或“放热”)反应.
(3)该课题组对影响沉钒率的其他因素(除温度和pH)提出如下假设.
假设一:氯化铵溶液的浓度
假设二:偏钒酸钠溶液浓度
…
(4)结合上述最佳条件设计实验验证假设一,写出实验步骤与结论.
限选试剂:0.5mol/L的偏钒酸钠溶液、1mol/L的氯化铵溶液、蒸馏水,常见实验仪器任选.(提示:沉钒率可用专用仪器测定并计算)
| 实验步骤与结论: |
(5)偏钒酸铵灼烧产生五氧化二钒,该反应的化学方程式为2NH4VO3$\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5.
 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.