题目内容
8.(1)如图所示表示一些晶体的结构(或晶胞),其中代表石墨是D;每一层内碳原子数与C-C化学键之比是2:3.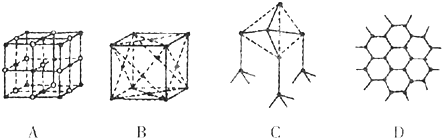
(2)MgO晶胞空间构型与NaCl晶体相同,MgO晶体中Mg2+的配位数为6与同个Mg2+等距且最近的O2-围成的空间几何构型是正八面体.MgO晶体熔点高于NaCl晶体,原因是MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl;
(3)若C、D代表某种元素中的两种同素异形体,C中原子的杂化类型是sp3,D能导电的原因是每个碳原子上未参与杂化的一个2p轨道上电子在层内离域运动(石墨中有自由电子).
分析 (1)石墨是层状结构,在层与层之间以范德华力相互作用,在层内碳与碳以共价键相互作用,形成六边形;利用均摊法进行有关计算;
(2)根据氯化钠中钠离子的配位数判断氧化镁中镁离子的配位数;同个Mg2+等距且最近的O2-围成的空间几何构型是正八面体;根据原子半径和电荷分析,电荷越大、离子半径越小其熔点越高.
(3)根据杂化轨道数=σ键个数+孤电子对数来判断杂化方式;导体能导电的原因是导体中含有在电流作用下能自由移动的电子.
解答 解:(1)石墨是层状结构,在层与层之间以范德华力相互作用,有分子晶体的特点,在层内碳与碳以共价键相互作用,形成六边形,D选项符合;
一个碳原子含有的碳碳键个数=$\frac{1}{2}$×3=1.5,所以碳原子个数和碳碳键个数比=1:1.5=2:3,
故答案为:D; 2:3;
(2)根据氯化钠的配位数知,氧化镁晶体中镁离子的配位数是6;同个Mg2+等距且最近的O2-围成的空间几何构型是正八面体;电荷越大、离子半径越小其熔点越高,MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl,所以MgO晶体熔点高于NaCl晶体,
故答案为:6;正八面体;MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl;
(3)C中每个原子含有4个σ键,所以采取sp3杂化,该物质中构成了一个空间网状结构,所以属于原子晶体;
D中每个原子含有3个σ键,所以采取sp2杂化;导体能导电的原因是导体中含有在电流作用下能自由移动的电子,石墨是导体,每个碳原子上未参与杂化的一个2p轨道上电子在层内离域运动(石墨中有自由电子),所以能导电.
故答案为:sp3;每个碳原子上未参与杂化的一个2p轨道上电子在层内离域运动(石墨中有自由电子).
点评 本题考查了晶体的结构、均摊法在晶胞计算中的应用、配位数的判断、杂化方式的判断等知识点,难度中等,注意杂化方式的判断是高考的热点,应熟练掌握.

| A. | NO | B. | O2 | C. | NO2和O2 | D. | NO和O2 |
| A. | SO2和H2S | B. | O2和NH3 | C. | CO2和H2 | D. | CH4和O2 |
| A. | 1molP4含有p-p键的个数为4NA | |
| B. | 1molSiC中含有C-Si键的个数为2NA | |
| C. | 含C为1mol的金刚石中含有C-C键的个数为2NA | |
| D. | 1molSi02中含Si-O键的个数为2NA |
| A. | a=b+m-n | B. | a=b-m+n | C. | a-m=b+n | D. | a-m=b-n |
| A. | ns2 | B. | ns2np1 | C. | ns2np4 | D. | ns2np5 |
| A. | 氢氟酸刻蚀玻璃 | B. | 四氯化碳作萃取剂 | ||
| C. | 氯气用子自来水消毒 | D. | 氢氧化铝用作胃酸中和剂 |
| A. | 质子数:C>d | B. | 离子还原性:Y>Z | C. | 稳定性:H2Y>HZ | D. | 原子半径:X<W |