题目内容
4.根据下列叙述,写出元素符号(1)A元素原子核外M层电子数是L层电子数的$\frac{1}{2}$:Si.
(2)B元素原子的最外层电子数是次外层电子数的1.5倍:B.
(3)C元素的次外层电子数是最外层电子数的$\frac{1}{4}$:Ne.
(4)D元素M层电子数是K层电子数的3倍:S.
分析 (1)A元素原子核外M层电子数是L层电子数的$\frac{1}{2}$,则M层电子数为4,由电子排布规律可知原子的电子数,然后根据核内质子数=核外电子数来解答;
(2)B元素的原子最外层电子是次外层电子的1.5倍,原子只能有2个电子层,最外层电子数为2×1.5=3,由电子排布规律可知原子的电子数,然后根据核内质子数=核外电子数来解答;
(3)C元素的次外层电子数是最外层电子数的$\frac{1}{4}$,则次外层电子数只能为2,由电子排布规律可知原子的电子数,然后根据核内质子数=核外电子数来解答;
(4)K层最多排2个电子,M层电子数是K层电子数的3倍,所以M层排6个电子,据此分析解答.
解答 解:(1)A元素原子核外M层电子数是L层电子数的$\frac{1}{2}$,则M层电子数为4,原子各层电子数分别为2、8、4,为Si元素,故答案为:Si;
(2)B元素的原子最外层电子是次外层电子的1.5倍,原子只能有2个电子层,最外层电子数为2×1.5=3,原子各层电子数分别为2、3,则B为B元素,故答案为:B;
(3)C元素的次外层电子数是最外层电子数的$\frac{1}{4}$,则次外层电子数只能为2,则最外层电子数为8,核外电子数为2+8=10,则核内质子数=核外电子数来,该元素为Ne,故答案为:Ne;
(4)K层最多排2个电子,M层电子数是K层电子数的3倍,所以M层排6个电子,所以该元素核外有2+8+6=16个电子,原子中原子序数=核外电子数,所以该元素的16号元素S,故答案为:S.
点评 本题考查了原子核外电子的排布,难度不大,明确电子的排布规则是解本题的关键.

练习册系列答案
相关题目
14.既能跟盐酸反应又能跟NaOH溶液反应的化合物是( )
| A. | Al | B. | Al2O3 | C. | Fe | D. | Fe2O3 |
15.已知A2+、B+、C3-、D-是第三周期元素的四种离子.下列叙述中正确的是( )
| A. | 四种离子都具有相同的电子层结构 | |
| B. | 原子半径:r(D)>r(C)>r(A)>r(B) | |
| C. | 离子半径:r(B+)>r(A2+)>r(C3-)>r(D-) | |
| D. | B、D两元素的最高价氧化物的水化物在溶液中反应的离子方程式可表示为H++OH-=H2O |
9.下列有关叙述正确的是( )
| A. | H、D、T具有相同的质子数,是氢元素的三种同位素 | |
| B. | OH-与H3O+组成元素相同,所含质子数相同 | |
| C. | 结构示意图为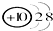 和 和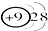 两种粒子为同一种元素 两种粒子为同一种元素 | |
| D. | 元素原子最外层电子数的多少是判断金属性和非金属性强弱的依据 |
16.用铁片和稀硫酸反应时,下列措施不能使生成氢气的速率加快的是( )
| A. | 对该反应体系加热 | B. | 不用稀硫酸,改用98%的浓硫酸 | ||
| C. | 加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
8.下列物质中,属于共价化合物的是( )
| A. | CaO | B. | N2 | C. | Na2O2 | D. | H2O |