题目内容
20.V2O5 是一种新型光电材料.某课题组模拟生产V2O5工艺部分流程如下:Ⅰ.配制偏钒酸钠(NaVO3)溶液
(1)向V2O5 固体中缓慢滴加NaOH溶液,边加热边搅拌至V2O5 固体完全溶解,反应的离子方程式为V2O5+2OH-=2VO3-+H2O.
Ⅱ.沉钒
一定条件下向偏钒酸钠溶液中加入氯化铵溶液,加热、搅拌得到偏钒酸铵沉淀.如图为部分因素对沉钒率的影响.
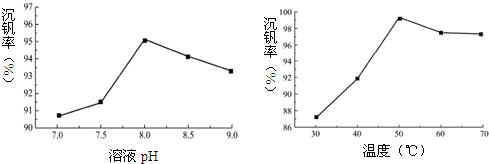
(2)为了提高沉钒率,应调节溶液pH=8.0.已知偏钒酸铵微溶于冷水,可溶于热水,结合图中信息,生成偏钒酸铵沉淀的反应是吸热(填“吸热”或“放热”)反应.
(3)该课题组对影响沉钒率的其他因素(除温度和pH)提出如下假设.
假设一:氯化铵溶液的浓度
假设二:偏钒酸钠溶液浓度
…
(4)结合上述最佳条件设计实验验证假设一,写出实验步骤与结论.
限选试剂:0.5mol/L的偏钒酸钠溶液、1mol/L的氯化铵溶液、蒸馏水,常见实验仪器任选.(提示:沉钒率可用专用仪器测定并计算)
| 实验步骤与结论: |
(5)偏钒酸铵灼烧产生五氧化二钒,该反应的化学方程式为2NH4VO3$\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5.
分析 (1)V2O5能够与NaOH反应生成偏钒酸钠和水;
(2)据图分析提高沉钒率的pH,随温度升高沉钒率增大,说明生成偏钒酸铵沉淀的反应是吸热反应;
(3)提高沉钒率的其他因素除氯化铵溶液的浓度外偏钒酸钠溶液浓度也可能有影响;
(4)作对比实验判断氯化铵溶液的浓度对沉钒率的影响;
(5)偏钒酸铵灼烧产生五氧化二钒,元素化合价没有变化,据原子守恒书写化学方程式.
解答 解:(1)V2O5与NaOH反应生成偏钒酸钠和水,反应的离子方程式为:V2O5+2OH-=2VO3-+H2O,故答案为:V2O5+2OH-=2VO3-+H2O;
(2)据图可知,pH=8时,沉钒率最高,随温度升高沉钒率增大,说明生成偏钒酸铵沉淀的反应是吸热反应,故答案为:8.0;吸热;
(3)提高沉钒率的其他因素除氯化铵溶液的浓度外偏钒酸钠溶液浓度也可能有影响,故答案为:偏钒酸钠溶液浓度;
(4)探究氯化铵溶液的浓度对沉钒率的影响,应使其他条件相同,氯化铵溶液的浓度不同,再使用专用仪器测定计算沉钒率,据若两份溶液沉钒率判断,具体步骤为
①取等体积0.5 mol/L的偏钒酸钠溶液,分别加入不同体积1 mol/L的氯化铵溶液,加入蒸馏水使两份溶液总体积相等,
②控制两份溶液温度均为50℃,pH均为8,
③使用专用仪器测定计算沉钒率,
若两份溶液沉钒率不同,则假设一成立.反之则不成立,
故答案为:①取等体积0.5 mol/L的偏钒酸钠溶液,分别加入不同体积1 mol/L的氯化铵溶液,加入蒸馏水使两份溶液总体积相等,
②控制两份溶液温度均为50℃,pH均为8,
③使用专用仪器测定计算沉钒率,
若两份溶液沉钒率不同,则假设一成立.反之则不成立;
(5)偏钒酸铵灼烧产生五氧化二钒,同时生成氨气和水蒸气,反应方程式为2NH4VO3 $\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5,故答案为:2NH4VO3 $\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5.
点评 本题通过模拟生产V2O5工艺流程考查了化学方程式书写、离子方程式书写、探究物质性质的方法和程序、图象分析,题目难度较大.

 口算能手系列答案
口算能手系列答案| A. | 乙烷和己烷 | B. | CH3COOH、C3H6O2 | C. |  和 和  | D. | HCHO、CH3COOH |
| A. | 硫酸溶液 | B. | 氨水溶液 | C. | 盐酸溶液 | D. | 氢氧化钠溶液 |
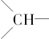 ),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )| A. | 4、6 | B. | 2、3 | C. | 3、6 | D. | 3、3 |
①S8分子中 S原子采用的轨道杂化方式sp3
②C2H4分子中只有以s轨道与sp2杂化轨道“头碰头”方式重叠而成的σ键
③SnBr2分子中Sn-Br的键角<120°
④H3O+中H-O-H键角比H2O中H-O-H键角大.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①③④ |
| A. | 离子化合物中不含共价键 | |
| B. | 共价化合物中不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性键不是化学键 |
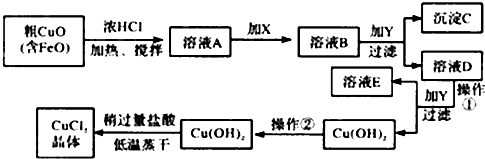
请结合表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.
| A. | CCl4可由CH4反应得到,可萃取碘水中的碘 | |
| B. | 石油和天然气的主要成分都是碳氢化合物 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
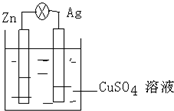 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”).电极反应式为Zn-2e-═Zn2+.