18.下列各组物质中,互为同分异构体的是( )
| A. | O2和O3 | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 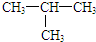 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
17.下列元素中,金属性最强的是( )
| A. | 钾 | B. | 钠 | C. | 镁 | D. | 铝 |
16.糖类是人体主要的能量来源.下列物质中,不属于糖类的是( )
| A. | 葡萄糖 | B. | 蔗糖 | C. | 淀粉 | D. | 酶 |
15.25℃时,下列有关CH3COOH和CH3COONa溶液关系正确的是( )
| A. | 适当加热CH3COONa溶液,c(OH-)会增大 | |
| B. | 0.10mol/L的CH3COOH溶液稀释10倍后:pH=2 | |
| C. | 0.10mol/L的CH3COONa溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH) |
13.利用低品位软锰矿浆(主要成分是MnO2,少量的Fe3+、Al3+等)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体可实现资源的综合利用和环境治理.

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
(1)写出浸出过程中主要反应的化学方程式SO2+MnO2=MnSO4.浸出过程中Fe3+转化为Fe2+,此转化的离子反应方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7~8.3.
②若加入的石灰浆过多,会使得MnSO4•H2O晶体中含有较多杂质,用离子反应方程式表示其原因Al(OH)3+3OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O.
(4)下列各组试剂中,能准确测定尾气中SO2含量的是b、c(选填序号).
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液.

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7~8.3.
②若加入的石灰浆过多,会使得MnSO4•H2O晶体中含有较多杂质,用离子反应方程式表示其原因Al(OH)3+3OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O.
(4)下列各组试剂中,能准确测定尾气中SO2含量的是b、c(选填序号).
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液.
12.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$) | |
| D. | pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
11.下列除去杂质(括号内为杂质)的方法中,正确的是( )
| A. | NO(NO2):通过装有水的洗气装置 | |
| B. | Cu粉(铁粉):加足量稀硝酸,过滤 | |
| C. | NH3(H2O):通过装有浓硫酸的洗气装置 | |
| D. | KCl(CaCl2):加适量Na2CO3溶液,过滤 |
10.下列有关物质的性质或用途的叙述中,错误的是( )
| A. | 硅晶体是一种重要的半导体材料 | |
| B. | 石墨可用做绝缘材料 | |
| C. | 漂白粉的有效成分是次氯酸钙 | |
| D. | 常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车 |
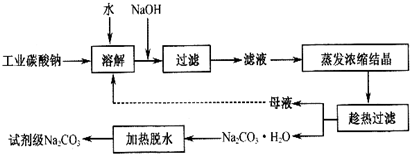
9.碳酸钠一种重要的化工原料.工业碳酸钠纯度约为 98%,其中含有 Ca2+、Mg2+、Fe3+、Cl-和 SO42-等杂质,提纯工艺线路如图:
有关物质的溶度积如表:
请回答下列问题:
(1)碳酸钠是制造普通玻璃的主要原料,请写出制造普通玻璃过程中发生的化学反应方程式SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑.
(2)上述提纯过程中加入NaOH溶液时,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2+CO32-;当溶液的pH=8时,溶液中c(Mg 2+):c(Fe3+)=2.125×1021.
(3)“母液”中除了含有 Na+、CO32-离子外,还含有Cl-、SO42-等离子.
(4)有人从“绿色化学”角度设想将“母液”直接进行循环使用.请你分析实际工业生产中是否可行不可行(填“可行”或“不可行”)并说明理由若“母液”循环使用,则溶液中 c(Cl-)和c(SO42-)增大,最后所得产物
Na2 CO3混有杂质.
(5)试剂级碳酸钠的检验标准为:纯度≥99.5%,为了检验提纯后的碳酸钠是否达标,实验室称取1.06g样品,溶于水配制成100mL溶液,量取20.00mL,滴入2滴甲基橙作为指示剂,用0.1000mol/L的标准盐酸进行滴定,三次滴定后使用盐酸的平均体积为39.84mL,请计算,该样品碳酸钠的纯度为99.6%.
0 168242 168250 168256 168260 168266 168268 168272 168278 168280 168286 168292 168296 168298 168302 168308 168310 168316 168320 168322 168326 168328 168332 168334 168336 168337 168338 168340 168341 168342 168344 168346 168350 168352 168356 168358 168362 168368 168370 168376 168380 168382 168386 168392 168398 168400 168406 168410 168412 168418 168422 168428 168436 203614

有关物质的溶度积如表:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
(1)碳酸钠是制造普通玻璃的主要原料,请写出制造普通玻璃过程中发生的化学反应方程式SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑.
(2)上述提纯过程中加入NaOH溶液时,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2+CO32-;当溶液的pH=8时,溶液中c(Mg 2+):c(Fe3+)=2.125×1021.
(3)“母液”中除了含有 Na+、CO32-离子外,还含有Cl-、SO42-等离子.
(4)有人从“绿色化学”角度设想将“母液”直接进行循环使用.请你分析实际工业生产中是否可行不可行(填“可行”或“不可行”)并说明理由若“母液”循环使用,则溶液中 c(Cl-)和c(SO42-)增大,最后所得产物
Na2 CO3混有杂质.
(5)试剂级碳酸钠的检验标准为:纯度≥99.5%,为了检验提纯后的碳酸钠是否达标,实验室称取1.06g样品,溶于水配制成100mL溶液,量取20.00mL,滴入2滴甲基橙作为指示剂,用0.1000mol/L的标准盐酸进行滴定,三次滴定后使用盐酸的平均体积为39.84mL,请计算,该样品碳酸钠的纯度为99.6%.

 ,②
,② 中氯原子较难水解.
中氯原子较难水解. 或
或 .
. .
.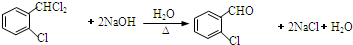 .
. .
. .
. ,写出由乙烯、甲醇为有机原料制备化合物
,写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$