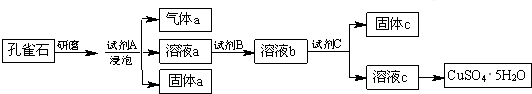
题目内容
15.25℃时,下列有关CH3COOH和CH3COONa溶液关系正确的是( )| A. | 适当加热CH3COONa溶液,c(OH-)会增大 | |
| B. | 0.10mol/L的CH3COOH溶液稀释10倍后:pH=2 | |
| C. | 0.10mol/L的CH3COONa溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH) |
分析 A.盐的水解是吸热反应,加热促进水解,乙酸钠为强碱弱酸盐,水解呈碱性;
B.CH3COOH是弱酸,存在电离平衡,加水促进电离;
C.根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再根据CH3COONa溶液呈碱性结合水的电离分析;
D.混合溶液呈酸性,则c(H+)>c(OH-),说明醋酸电离程度大于醋酸根离子水解程度.
解答 解:A.醋酸钠中含有弱离子醋酸根离子,可以和水电离出的氢离子结合生成醋酸CH3COONa+H2O?CH3COOH+NaOH,盐的水解是吸热反应,加热促进醋酸钠水解,c(OH-)会增大,故A正确;
B.CH3COOH是弱酸,存在电离平衡CH3COOH?CH3COO-+H+,加水促进电离,所以0.10mol/L的CH3COOH溶液稀释10倍后,pH变化小于1个单位,即所得溶液pH<2,故B错误;
C.溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因发生CH3COO-+H2O?CH3COOH+OH-,且还存在水的电离,c(OH-)>c(CH3COOH),则c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH),故C正确;
D.混合溶液呈酸性,则c(H+)>c(OH-),说明醋酸电离程度大于醋酸根离子水解程度,c(CH3COO-)>c(CH3COOH),结合电荷守恒得c(CH3COO-)>c(Na+),醋酸电离程度较小,溶液呈存在电离醋酸分子,所以溶液中微粒浓度大小顺序是c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故D错误,
故选AC.
点评 本题考查了影响弱电解质电离平衡的因素,注意电离是吸热过程,明确溶液中的溶质及溶液酸碱性再结合电荷守恒来分析解答,题目难度不大.

①蒸馏 ②过滤 ③静置分液 ④加入足量钠 ⑤通入足量CO2⑥加入足量NaOH溶液 ⑦加入乙酸和浓硫酸的混合液加热.
| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ③⑤①② | D. | ⑥① |
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为:Zn-2e-=Zn2+ | ||
| C. | 正极发生氧化反应 | D. | 正极反应为:Zn-2e-=Zn2+ |
| A. | 用不活泼金属铜作电极电解饱和食盐水:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | HCO3-离子水解方程式:HCO3-+H2O═H3O++CO32- | |
| C. | 乙烯通入溴水中:C2H4+Br2═CH2BrCH2Br | |
| D. | 氯化铁溶液与碳酸氢钠溶液混合:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑ |
| A. | 硅晶体是一种重要的半导体材料 | |
| B. | 石墨可用做绝缘材料 | |
| C. | 漂白粉的有效成分是次氯酸钙 | |
| D. | 常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车 |
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 无论怎样控制反应条件,2 mol SO2与1 mol O2 反应时都不会生成2 mol SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
| A. | 通入CH4 的电极为正极 | |
| B. | 正极的电极反应式为:2O2+8e-+4H2O═8OH- | |
| C. | 若甲烷通入量为1.12 L(标准状况)且反应完全,则电池中有0.1 mol O2 被氧化 | |
| D. | 通入甲烷的电极的电极反应式为:CH4+2O2+4e-═CO2+2H2O |
 短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.
短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.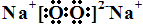 .
. .
.