题目内容
13.利用低品位软锰矿浆(主要成分是MnO2,少量的Fe3+、Al3+等)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体可实现资源的综合利用和环境治理.
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7~8.3.
②若加入的石灰浆过多,会使得MnSO4•H2O晶体中含有较多杂质,用离子反应方程式表示其原因Al(OH)3+3OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O.
(4)下列各组试剂中,能准确测定尾气中SO2含量的是b、c(选填序号).
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液.
分析 高温焙烧含硫废渣产生的SO2废气,软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,浸出液还含有少量的Fe2+、Al3+等其他金属离子,Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,在氧化后的液体中加入石灰浆,杂质中含有Fe2+、Al3+、Ca2+三种阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂,然后调节pH值在4.7~8.3间,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙,过滤,滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,由于制取的MnSO4•H2O含有结晶水,故操作a采用蒸发浓缩结晶的方法,得到MnSO4•H2O;
(1)从流程图看,浸出过程是软锰矿浆(MnO2)与SO2的反应;三价铁被二氧化硫还原成亚铁离子;
(2)杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+;
(3)①从表可以看出,只要调节pH值在4.7~8.3间,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀;
②若加入的石灰浆过多,氢氧化铝与氢氧化钙反应生成偏铝酸根离子;
(4)根据物质间能发生几步反应分析.
解答 解:(1)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,反应的化学方程式为SO2+MnO2=MnSO4,三价铁被二氧化硫还原成亚铁离子,离子反应方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,故答案为:SO2+MnO2=MnSO4;2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
(2)杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,
故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(3)①杂质中含有Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀,所以只要调节pH值在4.7~8.3间即可.
故答案为:4.7~8.3;
②若加入的石灰浆过多,氢氧化铝与氢氧化钙反应生成偏铝酸根离子,所以离子反应方程式为:Al(OH)3+OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O;
(4)a.二氧化硫和氢氧化钠反应生成亚硫酸钠,亚硫酸钠和二氧化硫、水又能反应生成亚硫酸氢钠,有两步反应,所以无法准确测定尾气中SO2含量,故a错误.
b.稀H2SO4酸化的KMnO4溶液和二氧化硫能发生氧化还原反应而使溶液褪色,只发生一步反应,所以能准确测定尾气中SO2含量,故b正确.
c.碘和二氧化硫能发生氧化还原反应而使溶液褪色,只发生一步反应,所以能准确测定尾气中SO2含量,故c正确.
d.氨水和二氧化硫反应生成亚硫酸铵,亚硫酸铵和二氧化硫和水又能反应生成亚硫酸氢铵,有两步反应,所以无法准确测定尾气中SO2含量,故d错误.
故答案为:b、c.
点评 本题以制备硫酸锰的生产流程为知识载体,考查化学反应的书写,及除杂中的问题,题目难度中等,本题注意把握数据处理能力和图象分析能力.

 名校课堂系列答案
名校课堂系列答案
| A. | 与金属钠反应时,只有键①断裂 | B. | 在Ag催化下与O2反应时,键①、③断裂 | ||
| C. | 与CuO反应时,只有键①断裂 | D. | 与浓硫酸共热至170℃时,键②、⑤断裂 |
| A. | 油脂在酸性条件下水解的反应称为皂化反应 | |
| B. | 煤的炼制方法中煤的气化和液化是物理方法,煤的干馏是化学方法 | |
| C. | 石油裂化的目的是提高轻质油的产量和质量 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 |
| A. | 明矾常作净水剂 | |
| B. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| C. | 在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 汽车尾气中的CO、NO等都是汽油和柴油的不完全燃烧产物 |
| A. | O2和O3 | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 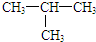 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |

| A. | Y的原子半径在同周期主族元素中最大 | |
| B. | W的非金属性比Z的弱 | |
| C. | Z的气态氢化物的稳定性在同主族元素中最强 | |
| D. | W的最高价氧化物对应的水化物是强酸 |
| A. | 只要使用合理的催化剂及载体,就可完全清除NO和CO | |
| B. | 使用催化剂只能改变反应的速率不能改变反应的平衡常数 | |
| C. | 假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) | |
| D. | 恒容条件下,通入惰性气体可提高NO转化率 |