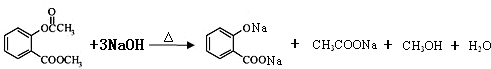
4.下列有关物质检验的实验结论中正确的组合是( )
| 实验操作 | 现象 | 实验结论 | |
| ① | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| ② | 将无色气体通入溴水中 | 溴水的黄色褪去 | 该气体可能是乙烯 |
| ③ | 向某溶液中滴入两滴KSCN溶液 | 溶液不显红色 | 该溶液一定含有Fe2+ |
| 另取该溶液少许,先滴入氯水,再 滴入KSCN溶液 | 溶液为红色 | ||
| ④ | 向某溶液中加入盐酸酸化的氯化钡 溶液 | 有白色沉淀产生 | 该溶液中可能含有SO42- |
| ⑤ | 将木炭和浓硫酸反应生成的气体通入 澄清石灰水中 | 有白色沉淀生成 | 该气体一定是CO2 |
| A. | ②④ | B. | ②③④ | C. | ①③⑤ | D. | ①②③④⑤ |
3.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和32,原子最外层电子数之和为10,A与C同主族,B与D同主族,A、C原子最外层电子数之和等于B原子的次外层电子数.则下列叙述中正确的是( )
| A. | D元素处于元素周期表中第3周期第Ⅳ族 | |
| B. | 四种元素的原子半径:r(A)<r(B)<r(C)<r(D) | |
| C. | B、D的最高价氧化物中,B、D与氧原子均为双键 | |
| D. | 一定条件下,B单质能转换出D单质,C产单质能置换出A单质 |
2.在复杂体系中,确定化学反应的先后顺序有利于解决问题,对下列各种操作所涉及的反应先后顺序的判断合理的是( )
| A. | 向含有等物质的量的Ba(OH)2、KOH、的混合溶液中通入CO2;与CO2反应的物质依次是KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+ 的混合溶液中加入Zn:与Zn反应的离子依次是Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2?、OH-、CO32- 的混合溶液中滴加盐酸:与盐酸反应的物质依次是AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 向含有等物质的量的AlCl3、HCl的混合溶液中滴加NaOH溶液,与NaOH反应的物质依次是AlCl3、HCl、Al(OH)3 |
1.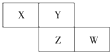 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的弱 | |
| D. | X与Y形成的化合物都易溶于水 |
16.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
0 168191 168199 168205 168209 168215 168217 168221 168227 168229 168235 168241 168245 168247 168251 168257 168259 168265 168269 168271 168275 168277 168281 168283 168285 168286 168287 168289 168290 168291 168293 168295 168299 168301 168305 168307 168311 168317 168319 168325 168329 168331 168335 168341 168347 168349 168355 168359 168361 168367 168371 168377 168385 203614
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 1 L 1mol/L的盐酸含有NA个HCl分子 | |
| C. | 标准状况下,33.6 L四氯化碳中含有氯原子的数目为6NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
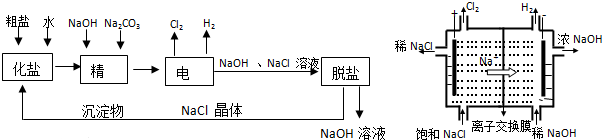
 .
.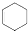 的六元环结构,六元环上只有一个取代基
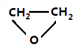
的六元环结构,六元环上只有一个取代基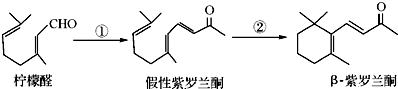
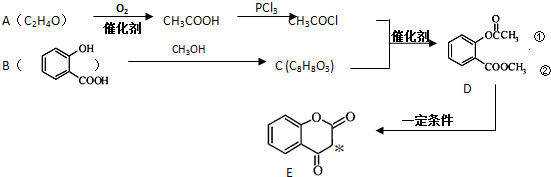
 .
.