20. 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
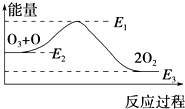
大气臭氧层的分解反应是:O3+O═2O2△H,该反应的能量变化如图所示,则下列叙述正确的是( )
 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.大气臭氧层的分解反应是:O3+O═2O2△H,该反应的能量变化如图所示,则下列叙述正确的是( )
| A. | 反应O3+O═2O2的△H=E1-E3 | B. | 反应O3+O═2O2是吸热反应 | ||
| C. | △H=△H1+△H2 | D. | 氯原子没有改变O3分解反应的历程 |
19.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | 0.01mol•L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | 0.1 mol•L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量的NH4Cl和NaCl的混合溶液:c(NH4+)+c(NH3•H2O)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(10-2-10-12) mol•L-1 |
18. 向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )
向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )
 向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )
向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )| A. | 水的电离程度一直增大 | |
| B. | 溶液的pH逐渐下降 | |
| C. | M、N两点对应的溶液中离子种类不同 | |
| D. | CD段反应的离子方程式为OH-+CO2=HCO3- |
16.CO2和CH4是两种重要的温室气体,通过化学反应可以将它们转化为其他物质.
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
①该反应的平衡常数表达式为K=$\frac{{c}^{2}(CO){c}^{2}({H}_{2})}{c(C{O}_{2})c(C{H}_{4})}$.
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.

(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
| 温度/℃ | 200℃ | 250℃ | 300℃ |
| 平衡常数/(mol•L-1)2 | K1 | K2 | 80 |
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.
13.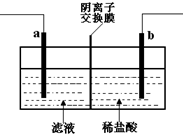 已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
0 168100 168108 168114 168118 168124 168126 168130 168136 168138 168144 168150 168154 168156 168160 168166 168168 168174 168178 168180 168184 168186 168190 168192 168194 168195 168196 168198 168199 168200 168202 168204 168208 168210 168214 168216 168220 168226 168228 168234 168238 168240 168244 168250 168256 168258 168264 168268 168270 168276 168280 168286 168294 203614
 已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )| A. | 电解时,电极a应与外电源的正极相连 | |
| B. | 电解时,电极b周围产生无色无味的气体 | |
| C. | 电解时,电极a发生的反应是:2Cl--2e-=Cl2↑ | |
| D. | 电解时,可以用氯化钠溶液替代稀盐酸 |
 锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.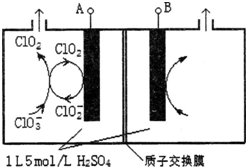 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.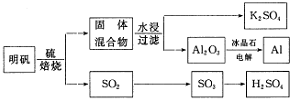
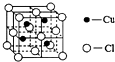 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.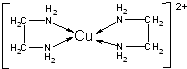
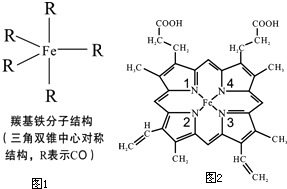 Fe、C、N、O、H可以组成多种物质.回答以下问题:
Fe、C、N、O、H可以组成多种物质.回答以下问题: