题目内容
20. 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
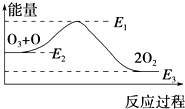
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.大气臭氧层的分解反应是:O3+O═2O2△H,该反应的能量变化如图所示,则下列叙述正确的是( )
| A. | 反应O3+O═2O2的△H=E1-E3 | B. | 反应O3+O═2O2是吸热反应 | ||
| C. | △H=△H1+△H2 | D. | 氯原子没有改变O3分解反应的历程 |
分析 由图可知,O+O3=2O2 的反应为放热反应,△H=E3-E2,由Cl+O3=ClO+O2 △H1、ClO+O=Cl+O2 △H2可知,利用盖斯定律来分析反应热的关系,氯原子在该反应中作催化催,改变了该反应的活化能,以此来解答.
解答 解:A.由图可知,生成物的能量低,O+O3=2O2 的反应为放热反应,△H=E3-E2,故A错误;
B.O+O3=2O2 的反应中△H=E3-E2 <0,为放热反应,故B错误;
C.由Cl+O3=ClO+O2 △H1、ClO+O=Cl+O2 △H2可知,根据盖斯定律两个反应相加得到O+O3=2O2 ,即△H=△H1+△H2,故C正确;
D.氯原子在该反应中作催化催,改变了该反应的活化能,即改变了O3分解反应的历程,故D错误;
故选C.
点评 本题考查化学反应中的能量变化及盖斯定律,催化剂对反应的作用,明确信息及图象的分析是解答本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列元素中,金属性最强的是( )
| A. | 钠 | B. | 镁 | C. | 铝 | D. | 钾 |
6.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
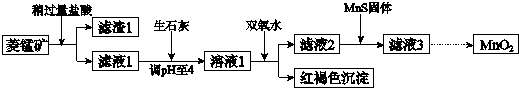
已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).

已知:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
3.下列说法中不正确的是( )
| A. | 原子晶体的熔点一定比分子晶体高 | |
| B. | SO2和SO3均是非极性分子 | |
| C. | PCl3分子中P-Cl的键角小于109°28? | |
| D. | 晶体中有阳离子必有阴离子 |
4. 按要求回答下列各题:
按要求回答下列各题:
(1)现有六种物质:①干冰;②金刚石;③四氯化碳;④氯化钙;⑤二氧化硅;⑥硫酸镁.请用编号填写下列空白:
(Ⅰ)熔化时需要破坏共价键的化合物是⑤
(Ⅱ)属于分子晶体且分子空间构型为直线型的是①,其电子式为
(Ⅲ)含有共价键的离子化合物是⑥.
(2)短周期中金属性最强的元素是Na(填元素符号);画出周期表中第三周期第VA族元素原子的结构示意图 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
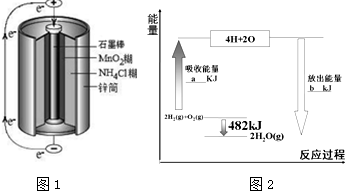
(3)锌锰干电池是最早使用的化学电源,其基本构造如图1所示.该电池的负极材料是Zn,若电路中通过0.4mole-,负极质量减少13g.工作时NH4+在正极放电产生两种气体,其中一种气体分子含10e-的微粒,正极的电极反应式为2NH4++2e-═2NH3↑+H2↑.
(4)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
根据图2中能量变化图,回答下列问题:
①图中:a=1370. ②表格中:X=463.
 按要求回答下列各题:
按要求回答下列各题:(1)现有六种物质:①干冰;②金刚石;③四氯化碳;④氯化钙;⑤二氧化硅;⑥硫酸镁.请用编号填写下列空白:
(Ⅰ)熔化时需要破坏共价键的化合物是⑤
(Ⅱ)属于分子晶体且分子空间构型为直线型的是①,其电子式为

(Ⅲ)含有共价键的离子化合物是⑥.
(2)短周期中金属性最强的元素是Na(填元素符号);画出周期表中第三周期第VA族元素原子的结构示意图
 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)(3)锌锰干电池是最早使用的化学电源,其基本构造如图1所示.该电池的负极材料是Zn,若电路中通过0.4mole-,负极质量减少13g.工作时NH4+在正极放电产生两种气体,其中一种气体分子含10e-的微粒,正极的电极反应式为2NH4++2e-═2NH3↑+H2↑.
(4)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ•mol-1 | 436 | 498 | X |
①图中:a=1370. ②表格中:X=463.
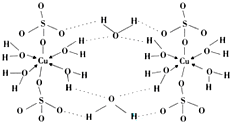 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: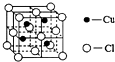 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.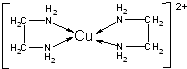
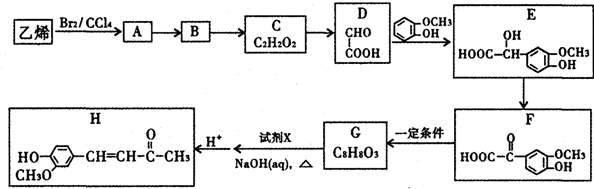
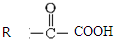 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ 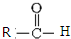 +CO2
+CO2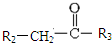 $\stackrel{NaOH(aq),△}{→}$
$\stackrel{NaOH(aq),△}{→}$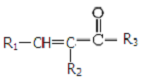 +H2O
+H2O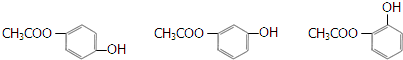 (其中之一).
(其中之一).