题目内容
15. 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.(1)铜基态原子的核外电子排布式为[Ar]3d104s1.
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对.
[Cu(NH3)n]+ 中Cu+ 与n个氮原子的空间结构呈直线形,n=2.
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(en)2]2+(en是乙二胺的简写):
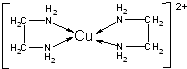
请回答下列问题:
①乙二胺分子中氮原子轨道的杂化类型为sp3杂化.
②配合物[Cu(en)2]Cl2中属于第二周期且第一电离能从大到小排列的是N>C.
③乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
④配合物[Cu(en)2]Cl2中不存在的作用力类型有E、F(填字母).
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
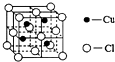
(4)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构单元如图所示.写出该反应的离子方程式2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
分析 (1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(2)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构;
(3)①根据N原子形成的共价键判断;
②同周期自左而右,电负性增大,据此判断C、N元素的电负性;
③乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
④由图可知:离子中存在配位键、C-N键、C-H键、N-H键、C-C键,据此判断离子化学键类型;
(4)利用均摊法确定M的化学式,铜离子和二氧化硫能发生氧化还原反应生成亚铜离子和硫酸根离子.
解答 解:(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构,则[Cu(NH3)n]+中Cu+与2个氮原子形成配位键,
故答案为:直线形;2;
(3)①乙二胺分子中氮原子形成4个共价键,则价层电子对数为4,其轨道的杂化类型为sp3杂化,故答案为:sp3杂化;
②同周期自左而右,电负性增大,电负性N>C,故答案为:N>C;
③乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高,
故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
③[Cu(en)2]Cl2中存在配位键、离子键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故不存在氢键和金属键;
故答案为:E、F;
(4)根据晶胞结构知,白色小球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色小球个数=4,所以该化合物的化学式为:CuCl,二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和氯化铜发生氧化还原反应生成氯化亚铜和硫酸,离子反应方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+,
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
点评 本题考查核外电子排布规律、电负性、杂化轨道、分子空间结构、氢键与化学键、配位键等,综合性较大,难度中等,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力.

| A. | CH3Br | B. | 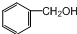 | C. | 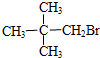 | D. | 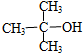 |
| A. | 核外电子排布相同的微粒,其化学性质也相同 | |
| B. | 含有金属元素和非金属元素的化合物不一定是离子化合物 | |
| C. | 仅含非金属元素的化合物一定是共价化合物 | |
| D. | 凡需要加热的反应一定是吸热反应 |
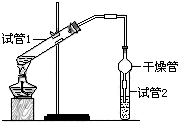 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实验室制备乙酸乙酯反应中起催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管2,再测有机层的厚度,实验记录如下:
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)干燥管在上述实验中的作用冷凝,防倒吸.
(3)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(4)分析实验AC(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收产物中的水,使平衡向生成乙酸乙酯方向移动.
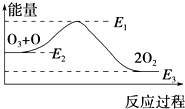 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.大气臭氧层的分解反应是:O3+O═2O2△H,该反应的能量变化如图所示,则下列叙述正确的是( )
| A. | 反应O3+O═2O2的△H=E1-E3 | B. | 反应O3+O═2O2是吸热反应 | ||
| C. | △H=△H1+△H2 | D. | 氯原子没有改变O3分解反应的历程 |
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z的原子半径r(T)>r(W)>r(Z) | |
| B. | 由X、Y、Z氢化物的热稳定性X>Y>Z | |
| C. | X最高价氧化物对应的水化物的酸性比W的弱 | |
| D. | W元素的单质具有半导体的特性,可以用于制造光导纤维 |
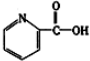 ②阿斯匹林
②阿斯匹林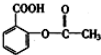
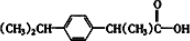 ④东茛菪内酯
④东茛菪内酯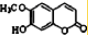

 ,其合成过程中涉及的反应类型分别是( )
,其合成过程中涉及的反应类型分别是( )