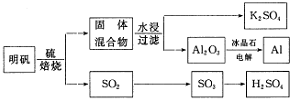
题目内容
2. 锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.(1)Li-SOCl2电池总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2,该反应的反应物和生成物中不存在的相互作用是c(填序号).
a.离子键 b.共价键 c.氢键 d.范德华力 e.金属键
(2)亚硫酰氯(SOCl2)中硫的化合价为+4,1molSOCl2中的σ键数目是3NA.S、O、Cl三种元素电负性从大到小的顺序是O>Cl>S.
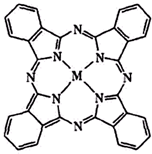
(3)在Li-SOCl2电池的碳正极中加入金属酞菁配合物可提高电池的容量和寿命.如图为一种铁酞菁配合物的结构,其中M为Fe2+,写出Fe2+的价电子排布式3d6.请在图中用箭头表示出配位键.
(4)人们发现Li+溶剂化倾向和形成共价键倾向很强,提出类似氢键的锂键.如LiF•HF中就存在锂键,下列LiF•HF的结构式正确的是(其中锂键用…表示)b.(填序号)
a.F-H…Li-F b.H-F…Li-F.
分析 (1)活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,分子晶体中存在范德华力,金属晶体中存在金属键;
(2)SOCl2中O元素为-2价、Cl元素为-1价,根据化合价的代数和为0确定S元素化合价;1个SOCl2中的σ键数目是3,元素非金属性越强,其电负性越大;
(3)Fe是26号元素,其原子核外有26个电子,Fe原子失去最外层2个电子生成Fe2+,其3d能级上5个电子为其价电子;配位键由含有孤电子对的原子指向含有空轨道的原子;
(4)锂键应该是Li原子和F原子形成的分子间作用力.
解答 解:(1)活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,分子晶体中存在范德华力,金属晶体中存在金属键,
该反应中Li中存在金属键,SOCl2和SO2中存在极性键和范德华力,S中存在非极性键和范德华力,LiCl中存在离子键,所以只有氢键不存在,故选c;
(2)SOCl2中O元素为-2价、Cl元素为-1价,根据化合价的代数和为0确定S元素化合价为+4价;1个SOCl2中的σ键数目是3,所以1molSOCl2中的σ键数目是3NA;元素非金属性越强,其电负性越大,这几种元素电负性大小顺序是O>Cl>S,
故答案为:+4;3NA;O>Cl>S;
(3)Fe是26号元素,其原子核外有26个电子,Fe原子失去最外层2个电子生成Fe2+,其3d能级上5个电子为其价电子,则其价电子排布式为3d6;配位键由含有孤电子对的原子指向含有空轨道的原子,配位键表示为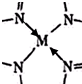 ,故答案为:3d6;
,故答案为:3d6; ;
;
(4)锂键应该是Li原子和F原子形成的分子间作用力,故选b.
点评 本题考查物质结构和性质,为高频考点,涉及配位键、锂键、电负性、原子核外电子排布等知识点,难点是配位键表示方法,(4)题以氢键为例采用知识迁移方法解答,注意配位键属于共价键、氢键属于分子间作用力.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A. | A | B. | B | C. | C | D. | D |
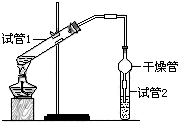 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实验室制备乙酸乙酯反应中起催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管2,再测有机层的厚度,实验记录如下:
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)干燥管在上述实验中的作用冷凝,防倒吸.
(3)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(4)分析实验AC(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收产物中的水,使平衡向生成乙酸乙酯方向移动.
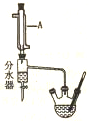 实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度g.cm-3 | 沸点/ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(1)仪器A的名称冷凝管.
(2)反应时加热有利于提高的产率,但温度过高酯的产率反而降低,其可能的原因是温度过高时,正丁醇、乙酸易挥发,且副反应增加,导致酯产率降低.
(3)用分水器分出冷凝水的目的使用分水器分离出水,使平衡正向移动,提高反应产率,步骤I中判断反应终点的依据是分水器中的水层量不再增加.
II.乙酸正丁酯粗产品的精制:
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,该步骤作的目的是饱和Na2CO3溶液可溶解正丁醇,中和酸,从而除去产品中的杂质
(2)用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是有机层从分液漏斗上口倒入一个干燥的蒸馏烧瓶中.
(3)将酯层进行蒸馏.蒸馏手机乙酸正丁酯产品时,应将温度控制在126.1℃左右.
III.计算产率:称量制得的乙酸正丁酯的质量为12.76g,则乙酸正丁酯的产率为55%.
①CH3CHO ②CH3CH2CH2CH2OH ③(CH3)3CH ④CH3CH2CH2CH3.
| A. | ②④①③ | B. | ②①④③ | C. | ①②③④ | D. | ①②④③ |