题目内容
1. 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为5ClO2-+4H+=4ClO2↑+Cl-.向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快.产生气体速率迅速加快的原因是:反应生成的氯离子对该反应起催化作用.
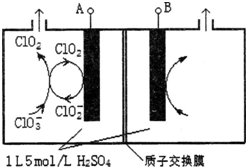
(2)电解法是目前研究最为热门的生产ClO2的方法之一.如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验.
①电源负极为A极(填A或B):
②写出阴极室发生反应依次为:ClO2+e-=ClO2-、ClO3-+ClO2-+2H+=2ClO2↑+H2O;
(3)已知:
2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1
2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1
将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=$\frac{8}{3}$.
分析 (1)反应物为亚氯酸钠,所在环境为酸性环境,生成物为ClO2气体,且知此反应为歧化反应,据此书写离子反应方程式即可;改加pH相同的硫酸,氢离子浓度不变,应考虑氯离子的影响;
(2)①与电源负极相连的一极为阳极,溶液中的阳离子在此电极得到电子,发生还原反应;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2;
(3)2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 (i),2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1(ii),[(i)-(ii)]÷2得目标方程式,利用三段法计算平衡常数,据此解答即可.
解答 解:(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,故化合价由+3价升高到+4价,故部分氯离子降低为-1价,离子反应方程式为:5ClO2-+4H+=4ClO2↑+Cl-,反应开始时,溶液中氯离子浓度很小,随着反应的进行,溶液中氯离子浓度增大,反应速率加快,可见氯离子起催化作用,故答案为:5ClO2-+4H+=4ClO2↑+Cl-;反应生成的氯离子对该反应起催化作用;
(2)①由图可知,ClO2在电极A上得到1个电子,生成ClO2-,故A应为电源的负极,故答案为:A;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2,离子反应方程式为:ClO3-+ClO2-+2H+=2ClO2↑+H2O,
故答案为:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O;
(3)2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 (i),2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1(ii),[(i)-(ii)]÷2得:NO2(g)+SO2 (g)?SO3 (g)+NO(g),故△H=$\frac{-196.6-(-113.0)}{2}$=-41.8,
a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=$\frac{4}{5}$a,故平衡常数K=$\frac{c(S{O}_{3})×c(NO)}{c(N{O}_{2})×c(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{\frac{16}{25}{a}^{2}}{\frac{1}{5}a×\frac{6}{5}a}$=$\frac{8}{3}$,故答案为:-41.8;b;$\frac{8}{3}$.
点评 本题以NO2、SO2、CO等物质为载体,综合考查化学平衡移动、盖斯定律以及平衡常数的计算等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| A. | 原子半径逐渐减小 | B. | 最高正化合价逐渐增大 | ||
| C. | 电子层数逐渐增多 | D. | 元素的非金属性逐渐增强 |
| A. | 在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 | |
| B. | 在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 | |
| C. | 在氯碱工业,电解槽一般用铁网作电极 | |
| D. | 合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法 |

(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
| 温度/℃ | 200℃ | 250℃ | 300℃ |
| 平衡常数/(mol•L-1)2 | K1 | K2 | 80 |
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.
 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H=2△H1+△H2-2△H3.(用△H1、△H2和△H3表示)
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
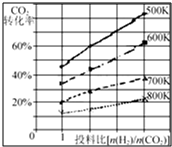
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
②升高温度,CO2的转化率降低;
③温度越低,增大投料比使CO2的转化率增大的越显著.
(4)为提高CO2的转化率,除了适当改变温度、压强和投料比外,还可以采取的措施是:将水蒸汽液化移去(或移去产物).
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4.与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是浓H2SO4腐蚀设备或有硫酸废液产生.
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,A2+H2?2HA K=5.6×107 B2+H2?2HB K=43 | 非金属性:A>B |
| A. | A | B. | B | C. | C | D. | D |

 .
.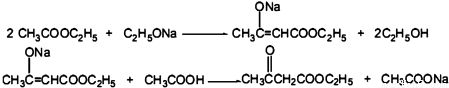

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.